
题目列表(包括答案和解析)
(16分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题: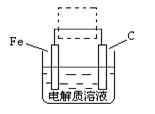
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 ==6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,
==6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,
转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程表示)
(4)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式 。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为 。
(16分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 ==6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,
==6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,
转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 。
 (3)与明矾相似,硫酸铁也可用作净水剂,其原理为
(用离子方程表示)
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为
(用离子方程表示)
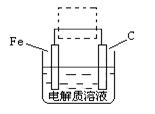
(4)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改 即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式 。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为 。
| ||
 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH为
溶液的pH为 ”标志的是
”标志的是 (2010?天河区二模)铁及其化合物在日常生活应用广泛,请根据下列实验回答问题:
(2010?天河区二模)铁及其化合物在日常生活应用广泛,请根据下列实验回答问题:
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com