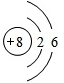
都由短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱.E在足量空气中燃烧产生刺激性气味气体G,G在大气中能导致酸雨的形成.E被足量氢氧化钠溶液吸收得到无色溶液F,溶液F在空气中长期放置发生反应,生成物之一为H. H与一种相对分子质量为78的供氧剂的结构和化学性质相似,其溶液显黄色.
请回答下列问题:
(1)组成单质A的元素位于周期表中的位置
第三周期ⅥA
第三周期ⅥA
.
(2)指出H物质中的化学键类型
离子键、共价健
离子键、共价健
.
(3)写出B与氢氧化钠溶液反应的离子方程式:
2Al+2OH-+2H2O═2AlO-2+3H2↑
2Al+2OH-+2H2O═2AlO-2+3H2↑
.
(4)E被足量NaOH溶液吸收得到溶液中的离子浓度由大到小关系是
C(Na+)>C(S2-)>C(OH-)>C(HS-)>C(H+)
C(Na+)>C(S2-)>C(OH-)>C(HS-)>C(H+)
.
(5)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯.当生成2mol二氧化氯时,转移电子
2
2
mol.
(6)溶液F在空气中长期放置生成H的化学反应方程式为:
4Na2S+O2+2H2O═4NaOH+2Na2S2(或2Na2S+O2+2H2O═4NaOH+2S,Na2S+S═Na2S2)
4Na2S+O2+2H2O═4NaOH+2Na2S2(或2Na2S+O2+2H2O═4NaOH+2S,Na2S+S═Na2S2)
.