(2013?德州二模)2012年冬天,我国城市空气污染状况受到人们的强烈关注.在空气质量报告中,SO
2的指数是衡量空气质量好坏的重要指标.为了测定空气中的SO
2含量,有三位同学分别采用了以下测定方法.
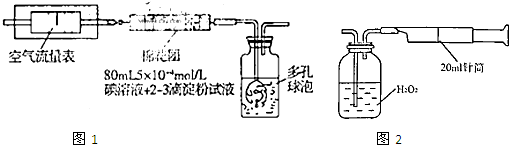
I.氧化还原法:甲同学拟采用图1所示的装置进行实验:
(1)该实验需要80mL5×10
-4mol/L的碘溶液,甲同学应称量I
20.013g
0.013g
g(精确到0.001),选择
100
100
mL的容量瓶进行配制.该实验所涉及的氧化还原反应原理为
I2+2H2O+SO2=H2SO4+2HI
I2+2H2O+SO2=H2SO4+2HI
(用化学方程式表示),该实验原理是利用了SO
2的
还原性
还原性
性.
(2)在甲同学所配碘溶液浓度准确,并且量取药品及实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO
2含量仍然比实际含量低,请分析其中可能的原因
装置气密性差、抽气速度过快、二氧化硫易溶于水而装置中的棉花团不干燥、部分二氧化硫溶于水后与水中溶解的少量氧气反应生成硫酸而损失(其他合理答案即可)
装置气密性差、抽气速度过快、二氧化硫易溶于水而装置中的棉花团不干燥、部分二氧化硫溶于水后与水中溶解的少量氧气反应生成硫酸而损失(其他合理答案即可)
.
Ⅱ.重量法:乙同学拟用图2所示简易装置进行实验.实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H
2O
2水溶液,用规格为20mL.的针筒抽气100次,使空气中的SO
2被H
2O
2水溶液充分吸收(SO
2+H
2O
2═H
2SO
4).在吸收后的水溶液中加入足量的BaCl
2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg.
(3)取样处空气中SO
2含量为
0.025
0.025
mg/L(精确到0.001).
(4)已知,常温下BaSO
3的K
SP为5.48×10
-7饱和亚硫酸溶液中c(SO
2-3)=6.3×10
-8mol/L.
有同学认为以上实验不必用H
2O
2吸收SO
2,直接用0.1mol/L BaCl
2溶液来吸收SO
2即可产生沉淀,请用以上数据分析这样做是否可行
因溶液中c(Ba2+)=0.1mol/L,c(SO42-)≤6.3×10-8mol/L,其离子积c(Ba2+)×c(SO42-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,所以直接用直接用0.1mol/L BaCl2溶液来吸收SO2不能产生BaSO3沉淀
因溶液中c(Ba2+)=0.1mol/L,c(SO42-)≤6.3×10-8mol/L,其离子积c(Ba2+)×c(SO42-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,所以直接用直接用0.1mol/L BaCl2溶液来吸收SO2不能产生BaSO3沉淀
.
III.仪器法:丙同学直接使用一种SO
2浓度智能监测仪测定空气中的SO
2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO
2浓度的.该电池总的化学反应原理为:2SO
2+O
2+2H
2O═2H
2SO
4(5)请写出该电池负极的电极反应式
SO2+2H2O-2e-═2SO42-+4H+
SO2+2H2O-2e-═2SO42-+4H+
.


 (1)食品和药品关系人的生存和健康.
(1)食品和药品关系人的生存和健康.


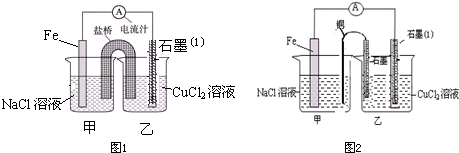 某实验小组同学对电化学原理进行了一系列探究活动.
某实验小组同学对电化学原理进行了一系列探究活动.