
题目列表(包括答案和解析)
某种碱式碳酸铜其组成可表示为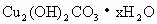 ,在加热的条件下,反应为
,在加热的条件下,反应为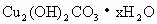
 2CuO+
2CuO+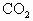 ↑+(x+1)
↑+(x+1)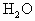 ,某同学粗略取一定样品,先后进行两个实验:实验(Ⅰ):测定
,某同学粗略取一定样品,先后进行两个实验:实验(Ⅰ):测定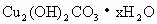 中x的值.实验
中x的值.实验
(Ⅱ)用实验(Ⅰ)中所得固体与氢气反应.
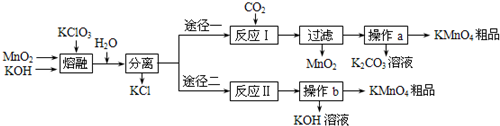
(1)现已装置好如下图所示的实验装置甲、乙,装置中一些附加设置均已略去,其中________是用来完成上述实验________的(填标号).为安全起见,本实验开始后应在你选用的装置的B处________.
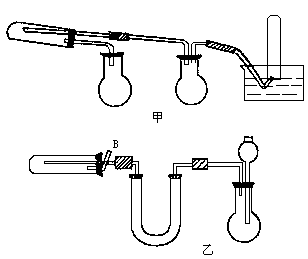
(2)用下图中的仪器(必要的铁架台、铁夹、酒精灯均在图中略去)组装一个实验装置,完成另一个实验.组装时,仪器按气流方向从左到右连接顺序为________→________→________→________,这套装置中,H的作用是什么________.
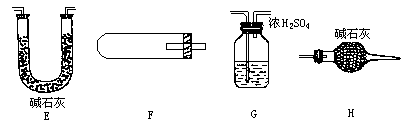
(3)为测定和计算碱式碳酸铜粉末中的x值,某个细心的同学在实验前后准确称量了一些仪器的质量(连同所盛试剂)分别记为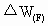 (F装置连同药品反应前后的质量差,取正值,下同)、
(F装置连同药品反应前后的质量差,取正值,下同)、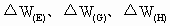 ,为求x,这几个数据可用的是________,它们的组合有________种.
,为求x,这几个数据可用的是________,它们的组合有________种.
| ||
| 温度 | 溶解度/g | ||
| K2CO3 | KOH | KMnO4 | |
| 20℃ | 111 | 112 | 6.38 |
| 60℃ | 127 | 154 | 22.1 |
| ||
| ||
室温下,将一定浓度的Na2CO3溶液滴入CnSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3—种沉淀;
假设二:这两者祁互促进水解,生成Cu(OH)2 —种沉淀,则此反应化学方程式为:____________________________;
假设三:生成的是CuCO3和Cu(OH)2两种沉淀。
(二)【理论探究】
查阅资料:CuCO3, Cu(OH)2均不带结晶水;;若由此数据判断,假设_______是不正确的。
(三)[实验探究]
步滋一:将CuCO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤,②_______,③干燥。
步骤三:利用下图所示装置,进行定量分析:
①仪器组装好后首先要进行的实验操作是_____________________。
②实验结束时通入过量空气的作用是_____________________。
③数据记录和分析:实验过程中测定的数据有:W1——样品的质量;W2——反应后装置B中残渣的质量;W3——反应生成的水的质量;W4——反应后生成二氧化碳的质量,为了测定其组成,至少需要其中 个数据,请将可能的组合填入下表中(每个空格中填一种组合,有几种组合就填几种,不必填满.)
室温下,将一定浓度的Na2CO3溶液滴入CnSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3—种沉淀;
假设二:这两者祁互促进水解,生成Cu(OH)2—种沉淀,则此反应化学方程式为:____________________________;
假设三:生成的是CuCO3和Cu(OH)2两种沉淀。
(二)【理论探究】
查阅资料:CuCO3, Cu(OH)2均不带结晶水;
Cu(OH)2均不带结晶水;
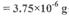 ;若由此数据判断,假设_______是不正确的。
;若由此数据判断,假设_______是不正确的。
(三)[实验探究]
步滋一:将CuCO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤,②_______,③干燥。
步骤三:利用下图所示装置,进行定量分析: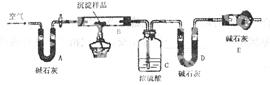
①仪器组装好后首先要进行的实验操作是_____________________。
②实验结束时通入过量空气的作用是_____________________。
③数据记录和分析:实验过程中测定的数据有:W1——样品的质量;W2——反应后装置B中残渣的质量;W3——反应生成的水的质量;W4——反应后生成二氧化碳的质量,为了测定其组成,至少需要其中 个数据,请将可能的组合填入下表中(每个空格中填一种组合,有几种组合就填几种,不必填满.)
室温下,将一定浓度的Na2CO3溶液滴入CnSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3—种沉淀;
假设二:这两者祁互促进水解,生成Cu(OH)2 —种沉淀,则此反应化学方程式为:____________________________;
假设三:生成的是CuCO3和Cu(OH)2两种沉淀。
(二)【理论探究】
查阅资料:CuCO3
, Cu(OH)2均不带结晶水;
 ;若由此数据判断,假设_______是不正确的。
;若由此数据判断,假设_______是不正确的。
(三)[实验探究]
步滋一:将CuCO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤,②_______,③干燥。
步骤三:利用下图所示装置,进行定量分析:

①仪器组装好后首先要进行的实验操作是_____________________。
②实验结束时通入过量空气的作用是_____________________。
③数据记录和分析:实验过程中测定的数据有:W1——样品的质量;W2——反应后装置B中残渣的质量;W3——反应生成的水的质量;W4——反应后生成二氧化碳的质量,为了测定其组成,至少需要其中 个数据,请将可能的组合填入下表中(每个空格中填一种组合,有几种组合就填几种,不必填满.)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com