
题目列表(包括答案和解析)
(15分)有关元素A.B.C.D的信息如下:
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 地壳中含量最高的元素,A与B可形成一种质量比为 7︰12的化合物(丙) |
| C | 单质曾用于焊接钢轨 |
| D | 单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
 可能是____________________mL。
可能是____________________mL。 A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。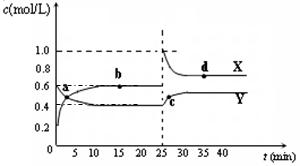
 ① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。
① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。(15分)有关元素A.B.C.D的信息如下:
|
元 素 |
有关信息 |
|
A |
最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
|
B |
地壳中含量最高的元素,A与B可形成一种质量比为 7︰12的化合物(丙)[来源:] |
|
C |
单质曾用于焊接钢轨 |
|
D |
单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
请回答下列问题:
(1)乙分子的空间构型________,用电子式表示乙的形成过程____________________。
(2)有关C与D元素,下列说法正确的是____________________ (填序号)。
① C或D的高价盐均可用做净水剂
② 用C或D单质做成的槽车,都可用来运输甲的稀溶液
③ C、D的单质与稀硫酸组成的原电池,C电极发生氧化反应
④ C的合金可用来做车船材料和门窗等
(3)B的一种氢化物在碱性溶液中可与丙反应,生成物中A元素只显其最高价态,该反应的离子方程式是________________________________________。
(4)现取1 mol/L 100 mL的C的氯化物溶液,向其中加入1 mol/L氢氧化钠溶液产生了3.9 g的沉淀,则加入的氢氧化钠溶液体积可能是____________________mL。
(5)已知:2AB2(g)  A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
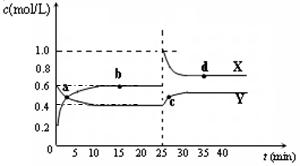
[来源:学。科。网Z。X。X。K]
① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。
② 25 min时,增加了_______(填物质的化学式)________mol。
③ a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_______(填字母)。
(14分) X、Y、Z、W、M、Q为原子序数依次增大的六种短周期元素,常温下,六种元素的常见单质中三种为气体,三种为固体。X与M,W与Q分别同主族, X是原子半径最小的元素,且X能与Y、Z、W分别形成电子数相等的三种分子,W是地壳中含量最多的元素。试回答下列问题:
(1)W、M、Q四种元素的原子半径由大到小的排列顺序是 > > (用元素符号表示)。
(2)元素M和Q可以形成化合物M2Q,写出M2Q的电子式 。
(3) Z、W、Q三种元素的简单气态氢化物中稳定性最强的是 ,沸点最低的是 。(用分子式表示)
(4) W的一种氢化物含18个电子, 该氢化物与QW2化合时生成一种强酸,其化学方程式为 。
(5)由X、Z、W、Q四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为 。
(6)由X、Z、W、Q四种元素组成的阴阳离子个数比为1:1的化合物A,已知A既能与盐酸反应生成气体,又能与氢氧化钠的浓溶液反应生成气体,且能使氯水褪色,写出A与足量氢氧化钠溶液在加热条件下反应的离子方程式 。
(7)分子式为X2Y2W4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为c(K+)> > > >c(OH-)。将2mL 0.1mol/L X2Y2W4的溶液和4mL0.01mol/L酸性KMnO4溶液混合,发现开始溶液颜色变化不明显,后溶液迅速褪色。解释原因 。
 2CA3(g)
2CA3(g)| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com