(1)三种弱酸HA、H
2B、HC,电离常数的数值为1.8×10
-5、5.6×10
-11、4.9×10
-10、4.3×10
-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
①HA+HB
-(少量)=A
-+H
2B
②H
2B(少量)+C
-=HB
-+HC
③HA(少量)+C
-=A
-+HC
则三种酸对应的电离常数分别为(请填空)
|
HA |
H2B |
HC |
|
Ka |
Ka1 |
Ka2 |
Ka |
| 数值 |
1.8×10-5 |
4.3×10-7 |
______ |
______ |
(2)25℃时0.1mol?L
-1的H
2D水溶液中,用氢氧化钠来调节溶液pH,得到含有H
2D、HD
-、D
2-三种微粒的溶液.
①当溶液的pH=7时,c(Na
+)=______(填微粒间量的关系).
②当c(Na
+)=c(D
2-)+c(HD
-)+c(H
2D)时溶液为______溶液(填物质的化学式).
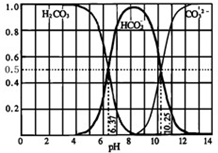
(3)如图是某水溶液在pH从0至14的范围内H
2CO
3、HCO
3-、CO
32-三种成分平衡时的组成分数.
①下列叙述正确的是______
A.此图是1.0mol?L
-1 碳酸钠溶液滴定1.0mol?L
-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H
2CO
3)=c(HCO
3-)=c(CO
32-)
C.人体血液的pH约为7.4,则CO
2在血液中多以HCO
3-形式存在
D.若用CO
2和NaOH反应制取NaHCO
3,应控制溶液的pH,不宜过大或过小
②已知Ksp(CaCO
3)=5.0×10
-9,在10mL1mol?L
-1 的Na
2CO
3溶液中,加入某浓度的盐酸,调节溶液的pH=10.25,此时溶液的体积恰好为100mL,向该溶液中加入1mL1×10
-4mol?L
-1的CaCl
2稀溶液,问是否有沉淀生成?______(填“是”或“否”)

 (3)如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.
(3)如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.