
题目列表(包括答案和解析)
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
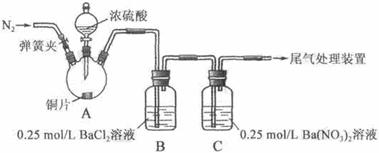
实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 |
|
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
⑴A中反应的化学方程式是 。
⑵C中白色沉淀是 ,该沉淀的生成表明SO2具有 性。
⑶C中液面上方生成浅棕色气体的化学方程式是 。
⑷分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是 ;
乙在A、B间增加洗气瓶D,D中盛放的试剂是 。
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
②进行实验,B中现象:
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因: 。
⑸合并⑷中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是 。
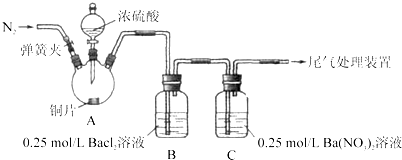
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
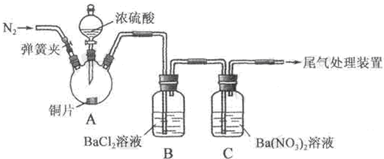
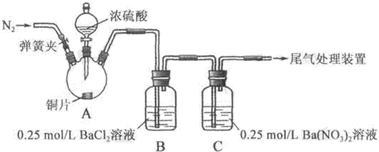
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | --- |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
| ||
| ||
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
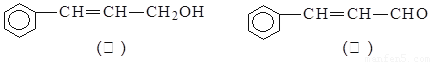
(1)乙中所含官能团的名称为 ;
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
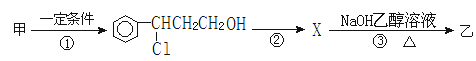
设计步骤①的目的是 ;指出①的反应类型 ;
反应②的化学方程式为 (注明反应条件)。
(3)欲检验乙中的含氧官能团,选用下列的一种试剂是__________。
A.溴水 B.酸性高锰酸钾溶液 C.溴的CCl4溶液 D.银氨溶液
(4)乙经过氢化、氧化得到丙(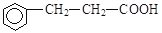 )。写出同时符合下列要求的丙的同分异构体结构简式__________________、_________________
)。写出同时符合下列要求的丙的同分异构体结构简式__________________、_________________
①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com