【化学一物质结构与性质】元素周期表中第四周期元素由于受3d电子的影 响,性质的递变规律与短周期元素略有不同,因此第四周期过渡元素具有和短周期元素不同的明显特征.
请回答下列问题:
(1)CO可以和很多过渡金属形成配合物,CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子里的共价键的类型按原子轨道的重叠方向分有
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.但
Ga 的第一电离能却明显低于
Zn,其原因是
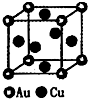
(3)如图是金与铜形成的金属互化物合金,它的化学式可表示为
(4)已知Ti
3+可形成配位数为6的配合物;现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,但相关实验证明,两种晶体 的组成皆为TiCl
3?6H
2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体样品配成待测溶液;
b.分别向待测溶液中滴入AgNO
3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水 溶液与AgNO
3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
.
则绿色晶体配合物的化学式为
(5)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是
A.苯与B
3N
3H
6互为等电子体
B.甲醛、苯和二氧化碳中碳原子均采用Sp
2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲酸高得多,是因为水分子间形成了氢键.


