
题目列表(包括答案和解析)
| ||
| ||


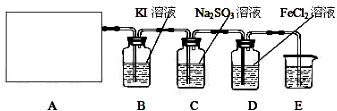
(13分)某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO42CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数)。
(2)该实验中A处可选用装置__________ _____ (填写装置的序号)。
(3)装置B中发生反应的离子方程式为________________________________________。
(4)装置C中的现象为___________________________________________________,
试结合反应方程式解释其原因__________________________________ _
_________________________________ 。
(5)装置E中的试剂是______________(任填一种合适试剂的名称),其作用是________
_______________________________ ______。
(6)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验步骤)
_________________________________________________________________________
___________________________________________________ ______________
(14分)某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO42CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数)。
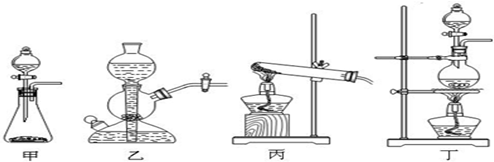
(2)该实验中A处可选用装置__________ _____(填写甲.乙.丙或丁)。
(3)检查A装置的气密性的方法是用弹簧夹夹住 处(填a.b.c或d)橡皮管,向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静止观察,当观察到分液漏斗中 时,表明该装置不漏气 .
(4) 装置B中发生反应的离子方程式为_____________________。
(5)装置C中的现象为____________________________________
(6)装置E中的试剂是______________(任填一种合适试剂的名称),
其作用是______________________________
(7)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验步骤)
___________________________________________________________
某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO42CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数)。
(2)该实验中A处可选用装置__________ _____(填写甲.乙.丙或丁)。
(3)检查A装置的气密性的方法是用弹簧夹夹住 处(填a.b.c或d)橡皮管,向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静止观察,当观察到分液漏斗中 时,表明该装置不漏气 。
(4)装置B中发生反应的离子方程式为_____________________。
(5)装置C中的现象为____________________________________。
(6)装置E中的试剂是______________(任填一种合适试剂的名称),
其作用是______________________________
(7)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验步骤)
___________________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com