
题目列表(包括答案和解析)
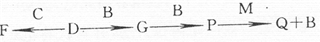



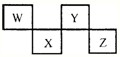 W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族.请回答下列问题.
W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族.请回答下列问题.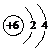
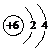
| 1 |
| 2 |
| 1 |
| 2 |


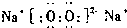
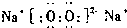
| X | L层电子数是K层电子数的3倍 |
| Y | 核外电子层数等于原子序数 |
| Z | L层电子数是K层和M层电子数之和 |
| W | 最外层电子数是次外层电子数的2.5倍 |


| ||
| ||
| ||
| ||
针对下面10种元素,完成以下各小题。
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 |
|
|
| C | N | O |
| Ne |
| 3 | Na | Mg | Al | Si |
| S | Cl | m] |
(1)地壳中含量最多的元素是 (填名称)。
(2)化学性质最不活泼的元素是 (填元素符号)。
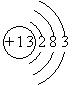
(3)Al的原子结构示意图为 。
(4)C与N相比,原子半径较小的是 。
(5)最高价氧化物对应的水化物碱性最强的是 (填化学式)。
(6)MgO和Al2O3中,属于两性氧化物的是 。
(7)S和Cl相比,元素非金属性较强的是 。
(8)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出反应的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com