
题目列表(包括答案和解析)
| |||||||||||||||||||
电解质的电离
酸、碱、盐的电离
(1)酸、碱、盐溶液导电的原因:以NaCl为例分析.NaCl晶体是由带________的Na+和带________的Cl-构成的,晶体中的离子(Na+和Cl-)________自由移动,因此NaCl晶体________导电.当NaCl溶于水时,Na+和Cl-就会逐渐脱离晶体的表面进入溶液成为________的离子,这些离子因为带电荷,所以在电场作用下会发生________移动,因此NaCl溶液导电.当将NaCl晶体加热至熔化时,晶体中的Na+和Cl-也会成为________的离子,因此液态的NaCl也能导电.
(2)电离:化合物溶于水或熔化时,离解成能够移动的离子的过程称为电离.酸、碱、盐在溶于水或受热熔化时能发生电离,其特点为:酸:电离时产生的阳离子全部是________.碱:电离时产生的阴离子全部是________.盐:电离时产生的阳离子为________(或![]() ),阴离子是________.
),阴离子是________.
(3)电离方程式:表示电离的式子.
HCl![]() ________,
________,
NaOH![]() ________,
________,
NaCl![]() ________
________
| b |
| a-b |
| b |
| a-b |
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
| c(H+) |
| c(HF) |
| c(OH-) |
| c(H+) |
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
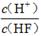 D.
D.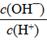
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com