
题目列表(包括答案和解析)
下列褪色过程不是因为氧化还原反应而褪色的是 ( )
A.SO2气体通入到溴水中使溴水褪色
B.氯水使滴有酚酞的NaOH溶液褪色,再加入NaOH后不变红
C.乙二酸洗去溅在布条上的蓝墨水
D.在含有碘单质的淀粉溶液中,加入KOH溶液后蓝色褪去
Ⅰ:利用水煤气合成二甲醚的三步反应如下:
①2H (g)+CO(g)
(g)+CO(g) CH
CH OH(g);ΔH=-90.8 kJ·mol
OH(g);ΔH=-90.8 kJ·mol
②2CH OH(g)
OH(g) CH
CH OCH
OCH (g)+H
(g)+H O(g);ΔH=-23.5 kJ·mol
O(g);ΔH=-23.5 kJ·mol
③CO(g)+H O (g)
O (g) CO
CO (g)+H
(g)+H (g);ΔH=-41.3 kJ·mol
(g);ΔH=-41.3 kJ·mol
总反应:3H (g)+3CO(g)
(g)+3CO(g) CH
CH OCH
OCH (g)+CO
(g)+CO (g)的ΔH=__________:
(g)的ΔH=__________:
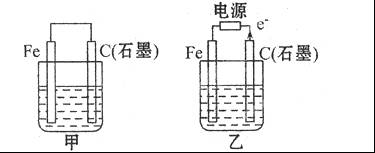
Ⅱ:如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有饱和NaCI溶液。
①甲中石墨棒上的电极反应式__________,电子的移动方向为________;
②乙中总反应的离子方程式为__________,Cl 移向__________电极(填Fe或C);
移向__________电极(填Fe或C);
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl 氧化了生成的I
氧化了生成的I 。若反应中Cl
。若反应中Cl 和I
和I 的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;
的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;
(2)若甲、乙两烧杯中均盛有CuSO 溶液。
溶液。
①甲中铁棒上的电极反应式为:______________________;
②如果起始时乙中盛有200 mL pH=5的CuSO 溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。
溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。
Ⅰ:利用水煤气合成二甲醚的三步反应如下:
①2H![]() (g)+CO(g)
(g)+CO(g)![]() CH
CH![]() OH(g);ΔH=-90.8 kJ·mol
OH(g);ΔH=-90.8 kJ·mol![]()
②2CH![]() OH(g)
OH(g)![]() CH
CH![]() OCH
OCH![]() (g)+H
(g)+H![]() O(g);ΔH=-23.5 kJ·mol
O(g);ΔH=-23.5 kJ·mol![]()
③CO(g)+H![]() O (g)
O (g)![]() CO
CO![]() (g)+H
(g)+H![]() (g);ΔH=-41.3 kJ·mol
(g);ΔH=-41.3 kJ·mol![]()
总反应:3H![]() (g)+3CO(g)
(g)+3CO(g)![]() CH
CH![]() OCH
OCH![]() (g)+CO
(g)+CO![]() (g)的ΔH=__________:
(g)的ΔH=__________:
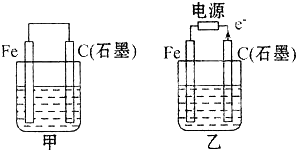
Ⅱ:如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有饱和NaCI溶液。
①甲中石墨棒上的电极反应式__________,电子的移动方向为________;
②乙中总反应的离子方程式为__________,Cl![]() 移向__________电极(填Fe或C);
移向__________电极(填Fe或C);
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl![]() 氧化了生成的I
氧化了生成的I![]() 。若反应中Cl
。若反应中Cl![]() 和I
和I![]() 的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;
的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;
(2)若甲、乙两烧杯中均盛有CuSO![]() 溶液。
溶液。
①甲中铁棒上的电极反应式为:______________________;
②如果起始时乙中盛有200 mL pH=5的CuSO![]() 溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。
溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。
| ||
| ||
H![]() CaC2O4↓(白色)+2H2O
CaC2O4↓(白色)+2H2O
为探究乙二酸晶体(H

回答下列问题:
(1)乙二酸晶体(H
(2)a处试剂的名称是______________,反应一段时间后a处的现象为__________________。
(3)足量澄清石灰水的作用是____________________________________。
装置乙不能缺少,理由是________________________________________________。
(4)丙中b处逸出的气体可能是___________。检验的方法是___________(用化学方程式表示)。
(5)简述检查上述装置气密性的方法:____________________________________________。
(6)乙二酸还可能具有的性质是______________________。(填序号)
A.能与银氨溶液发生银镜反应
B.能使酸性KMnO4溶液褪色
C.能与Na2CO3反应生成CO2
D.能使蓝墨水褪色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com