
题目列表(包括答案和解析)


(5分)短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍。
(1)W在周期表中的位置是 。
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为 。
(3)X、Y、Z三种元素组成的化合物中存在的化学键类型为 。
(4)Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为 。
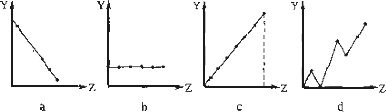
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
①ⅡA族元素的最外层电子数________.
②第3周期元素的最高化合价________.
③F-、Na+、Mg2+、Al3+的离子半径________.
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①Y和M形成的常见化合物的化学式是________.
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若A能抑制水的电离,B能促进水的电离,则化合物A的化学式为________,B的化学式是________.
③Z与Y形成的稳定化合物的电子式为________.
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成M单质的化学方程式:________该反应中转移的电子数目为________.

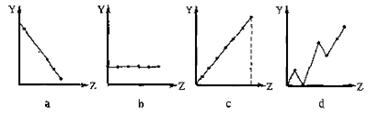
(13分) (1)(3分)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
①ⅡA族元素的最外层电子数 ▲ 。 ②第3周期元素的最高化合价 ▲ 。
③F-、 Na+ 、Mg2+、Al3+的离子半径 ▲ 。
(2)(10分)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子
最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为
3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①Y和M形成的常见化合物的化学式是 ▲ 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若A能抑制水的电离,B能促
进水的电离,则化合物A的化学式为 ▲ ,B的化学式是 ▲ 。
③Z与Y形成的稳定化合物的电子式为 ▲ 。
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成M单质的化学方程式: ▲
该反应中转移的电子数目为 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com