
题目列表(包括答案和解析)
Ⅰ.用如下化学实验方案的设计及要求—性质、制备和检验图所示装置进行Mg与SO2反应的实验。

(1)选择制取SO2的合适试剂____________________________________________。
①10%的H2SO4溶液 ②98%的H2SO4溶液 ③Na2SO3固体 ④CaSO3固体 ⑤Cu
(2)写出装置B中发生的主要反应的化学方程式___________________________________,
装置C中NaOH溶液的作用是_______________________________________________。
(3)你认为该装置是否有不足之处?________________________________,如果有,请一一说明____________________________________________________________。
Ⅱ.某研究小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应 ③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4 ④Si和SiO2均不与稀H2SO4反应 ⑤SiH4在空气中自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(4)该小组“实验室制Si”的化学方程式是_________________________________________。
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是_________________
____________________________________________________________________。

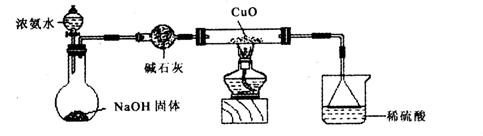
(1)证明氨气具有还原性。已知2NH3+3CuO![]() N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是___________,稀硫酸的作用是____________________________________。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
③证明NH3具有还原性的实验现象是_______________________________________________。
(2)用吸收了足量尾气的溶掖制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:
(NH4)2SO4+FeSO4+6H2O====(NH4)2Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe2+将转化为沉淀。
①吸收了a mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,请简述实验方法。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是__________________。
利用如图所示的装置和其他必要的仪器用品,完成下列实验。

(1)证明氨气具有还原性。已知2NH3+3CuO![]() N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是 ,稀硫酸的作用是 。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③证明NH3具有还原性的实验现象是 。
(2)用吸收了足量尾气的溶液制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:(NH4)2SO4+FeSO4+6H2O==(NH4)2 Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe外将转化为沉淀。
①吸收了![]() mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是 。
(1)下列有关实验的基本操作及安全知识的叙述,正确的是________(填序号.错选倒扣分,至本小题扣完为止).
A、用干燥的pH试纸测定氯水的pH
B、用结晶法可以除去硝酸钾中混有的少量氯化钠
C、切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
D、实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
E、浓硫酸不小心沾到皮肤上,立刻用稀烧碱溶液洗涤
F、在氢氧化铁胶体中滴加少量稀硫酸不会产生沉淀
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制.某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步聚1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步聚2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步聚3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
①上述实验中的过滤操作需要烧杯、________、________等玻璃仪器.
②步聚2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:________;
③步聚2中,判断加入BaCl2已过量的方法是:________;
④为检验精盐纯度,需配制100mL0.2mol/LNaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的错误是________、________.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com