
题目列表(包括答案和解析)

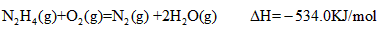
[ ]
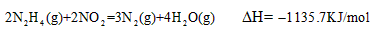
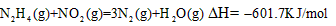
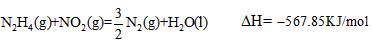

|
火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气.已知: N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 KJ/mol N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 KJ/mol 则N2H4和NO2反应的热化学方程式为 | |
| [ ] | |
A. |
2N2N4(g)+2NO2=3N2(g)+4H2O(g) ΔH=-1135.7 KJ/mol |
B. |
N2H4(g)+NO2(g)=3N2(g)+H2O(g) ΔH=-601,7KJ/mol |
C. |
N2H4(g)+NO2(g)= |
D. |
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7KJ/mol |
(14分)
(1)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g)+ 2O2(g)= 2NO2(g) △H = +67.7 kJ/mol;
N2H4(g)+ O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为__________________ 。
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为 酸(填“强”或“弱”), H2A的电离方程式为 ,该溶液中由水电离出的c(H+)= 。
(3)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a b(填“>”、“<”或“=”,下同)。
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a b。
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a b
(14分)
(1)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)= 2NO2(g) △H =" +67.7" kJ/mol;
N2H4(g)+ O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为__________________ 。
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为 酸(填“强”或“弱”), H2A的电离方程式为 ,该溶液中由水电离出的c(H+)= 。
(3)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a b(填“>”、“<”或“=”,下同)。
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a b。
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a b
(14分)
(1)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)= 2NO2(g) △H = +67.7 kJ/mol;
N2H4(g)+ O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为__________________ 。
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为 酸(填“强”或“弱”), H2A的电离方程式为 ,该溶液中由水电离出的c(H+)= 。
(3)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a b(填“>”、“<”或“=”,下同)。
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a b。
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com