
题目列表(包括答案和解析)
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核只有一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1。
请回答下列问题:

(1)这四种元素中电负性最大的是 (填元素符号)、第一电离能最小的是 (填元素符号) ;
(2)C所在的主族元素气态氢化物中,沸点最低的是 (填化学式);
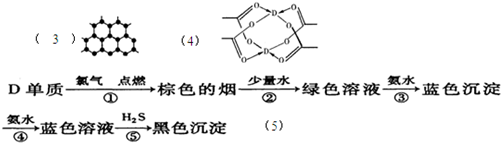
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为 ;
(4)D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是 (填选项序号);

①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下图:

已知D的硫化物为黑色难溶性物质,请书写第⑤反应的离子方程式: 。
(10分)请你按下列要求书写相应的方程式:
(1)用离子方程式解释NaAlO2溶液的碱性:
(2)5.6g金属铁与盐酸完全反应生成氯化亚铁溶液与氢气,同时放出热量Q KJ。
写出此反应热化学方程式: 。
(3)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。已知此燃料电池的负极反应式:CO+CO32--2e-=2CO2
则该电池工作时的正极反应式为: .
(4) FeCl3溶液腐蚀印刷电路铜板的,请写出该离子方程式为: 。
(5)将(4)反应设计成原电池,请在方框内画出原电池的装置图(标出正、负极、溶液)。
下图是元素周期表的框架,请在表中①~⑩元素中回答问题
| ① | | | |||||||||||||||
| | | | | | ② | ③ | ④ | | |||||||||
| ⑤ | ⑥ | ⑦ | | | | ⑧ | | ||||||||||
| ⑨ | | | | | | | | | | | | | | | | ⑩ | |
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(10分)请你按下列要求书写相应的方程式:
(1)用离子方程式解释NaAlO2溶液的碱性:
(2)5.6g金属铁与盐酸完全反应生成氯化亚铁溶液与氢气,同时放出热量Q KJ。
写出此反应热化学方程式: 。
(3)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。已知此燃料电池的负极反应式:CO+CO32--2e-=2CO2
则该电池工作时的正极反应式为: .
(4) FeCl3溶液腐蚀印刷电路铜板的,请写出该离子方程式为: 。
(5)将(4)反应设计成原电池,请在方框内画出原电池的装置图(标出正、负极、溶液)。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com