
题目列表(包括答案和解析)
| 催化剂△ |
硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸。
已知:①550℃时,![]() △H=-196.6KJ.mol-1
△H=-196.6KJ.mol-1
②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中N2与O2的体积
比为4:1):![]() ,
,![]()
(1) 550℃时,6.4 g SO2(g)与足量O2(g)充分反应生成SO3(g),放出热量
9.83 kJ (填“大于”、“等于”或“小于”)。
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是 。(填字母)
a.向平衡混合物中充入Ar b.向平衡混合物中充入O2
c.改变反应的催化剂 d.降低反应的温度
(3)为使FeS2完全生成Fe2O3,生产时要使用过量的空气,则当空气过量50%时,所得炉气中SO2的体积分数是多少?
(4)720 g纯净的FeS2在空气中完全煅烧,所得固体中Fe和O的物质的量之比n(Fe):n(O)=6: ![]() ,
,
此时消耗空气为![]() mol。
mol。
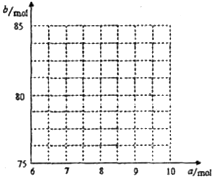
①试写出a与b的关系式: 。
②请在右图中画出![]() 与
与![]() 的关系曲线。
的关系曲线。
黄铁矿![]() Fe2(SO4)3
Fe2(SO4)3
CO2+H2O![]() C6H12O6
C6H12O6
(1)①从生物代谢过程看,b过程属________作用。
②氧化亚铁硫杆菌的代谢类型是________。
A.自养需氧型 B.异氧需氧型
C.自养厌氧型 D.异氧厌氧型
(2)写出a过程的化学方程式_________________。
(3)人们可以利用Fe2(SO4)3作氧化剂溶解铜矿石(Cu2S),然后,加入铁屑进一步得到铜,请写出其离子方程式___________________________。
(4)下列不属于细菌冶金特点的是_____________________。
A.对贫矿、尾矿的开采更有价值
B.中间产物FeSO4和S可再次被细菌氧化为Fe2(SO4)3和H2SO4,因此可循环使用
C.所有的细菌来源广泛,很容易找到并大规模培养
D.能大大降低能源消耗,减少污染
(5)工业上可利用粗铜(含Zn、Ag、Au)等经电解制备精铜,电解过程中,精铜接电源的________极,粗铜上的电极反应________。
(6)某工厂按上述(5)原理,平均每秒生产Amol Cu(设阿伏加德罗常数为N,电子电量为e库仑),求电解槽中的平均电流________。
“细菌冶金”是利用某些细菌的特殊代谢功能开采矿石,例如,在氧化亚铁硫杆菌的存在下,黄铁矿被空气氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如下:
黄铁矿![]() Fe2(SO4)3
Fe2(SO4)3
CO2+H2O![]() C6H12O6
C6H12O6
(1)①从生物代谢过程看,b过程属________作用。
②氧化亚铁硫杆菌的代谢类型是________。
A.自养需氧型 B.异氧需氧型
C.自养厌氧型 D.异氧厌氧型
(2)写出a过程的化学方程式_________________。
(3)人们可以利用Fe2(SO4)3作氧化剂溶解铜矿石(Cu2S),然后,加入铁屑进一步得到铜,请写出其离子方程式___________________________。
(4)下列不属于细菌冶金特点的是_____________________。
A.对贫矿、尾矿的开采更有价值
B.中间产物FeSO4和S可再次被细菌氧化为Fe2(SO4)3和H2SO4,因此可循环使用
C.所有的细菌来源广泛,很容易找到并大规模培养
D.能大大降低能源消耗,减少污染
(5)工业上可利用粗铜(含Zn、Ag、Au)等经电解制备精铜,电解过程中,精铜接电源的________极,粗铜上的电极反应________。
(6)某工厂按上述(5)原理,平均每秒生产Amol Cu(设阿伏加德罗常数为N,电子电量为e库仑),求电解槽中的平均电流________。
“细菌冶金”是利用某些细菌的特殊代谢功能开采矿石,例如,在氧化亚铁硫杆菌的存在下,黄铁矿被空气氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如下:
黄铁矿![]() Fe2(SO4)3 CO2+H2O
Fe2(SO4)3 CO2+H2O![]() C6H12O6
C6H12O6
(1)从生物代谢过程看,b过程属________作用.
(2)写出a过程的化学方程式________.
(3)人们可以利用Fe2(SO4)3作氧化剂溶解铜矿石(Cu2S),然后,加入铁屑进一步得到铜,请写出其离子方程式________.
(4)下列不属于细菌冶金特点的是________.
A.对贫矿、尾矿的开采更有价值
B.中间产物FeSO4和S可再次被细菌氧化为Fe2(SO4)3和H2SO4,因此可循环使用
C.所有的细菌来源广泛,很容易找到并大规模培养
D.能大大降低能源消耗,减少污染
(5)工业上可利用粗铜(含Zn、Ag、Au)等经电解制备精铜,电解过程中,精铜接电源的________极.粗铜上的电极反应________.
(6)某工厂按上述(5)原理,平均每秒生产A mol Cu(设阿伏加德罗常数为NA,电子电量为e库仑),求电解槽中的平均电流________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com