
题目列表(包括答案和解析)
|
(原创)下列溶液说法正确的是 | |
| [ ] | |
A. |
常温时,浓度均为0.01 mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO |
B. |
下图表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
|
C. |
1.0×10-3 mol/L盐酸的pH=3.0,1.0*10-8 mol/L盐酸的pH=8.0 |
D. |
分别将等体积的等pH的醋酸和盐酸加水稀释100倍,所得溶液的pH:③>④ |
常温下在20 mL 0.1 mol/L Na2CO3溶液中逐渐滴加入0.1 mol/L HCl溶液40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示,下列说法不正确的是
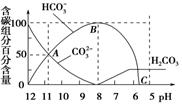
A.0.1 mol/L Na2CO3溶液中c(OH-)-c(H+)=2c(H2CO3)+c(HCO3-)
B.在A点c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.常温下CO2饱和溶液的pH约为5.6
D.0.05 mol/L NaHCO3溶液的pH=8

| A.0.1 mol/L Na2CO3溶液中c(OH-)-c(H+)=2c(H2CO3)+c(HCO3-) |
| B.在A点c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C.常温下CO2饱和溶液的pH约为5.6 |
| D.0.05 mol/L NaHCO3溶液的pH=8 |
常温下在20 mL 0.1 mol/L Na2CO3溶液中逐渐滴加入0.1 mol/L HCl溶液40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示,下列说法不正确的是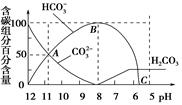
| A.0.1 mol/L Na2CO3溶液中c(OH-)-c(H+)=2c(H2CO3)+c(HCO3-) |
| B.在A点c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C.常温下CO2饱和溶液的pH约为5.6 |
| D.0.05 mol/L NaHCO3溶液的pH=8 |
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 __________________
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 ________ (填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 __ (填“甲”或“乙”)判断正确。试剂X是 ___________
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH _______ (填“高于”、“低于”或“等于”)8.3,则 __________ (填“甲”或“乙”)判断正确。
(3)常温下,在测得pH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH—浓度分别为amol /L和bmol /L,则a与b的具体关系是 ________
(4)25 ℃时,浓度均为0.3 mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是_________________
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
命题:林文土
6~~12 B B D A A C C
23、(19分)(1)2、5、6、7(3分,多选1个倒扣1分)
(2)①250mL容量瓶 34.75 (各1分)
②取最后的洗涤液,测定洗涤液的pH,若洗涤液的pH等于7,说明已经洗涤干净(或取最后的洗涤液,向其中滴加BaCl2溶液,若无浑浊产生,则说明已经洗涤干净。) (2分) ③ab (2分)
(3)Ⅰ、关闭活塞a、b,将出气导管口浸没在液面以下,用手掌或热毛巾紧贴烧瓶外壁一小会儿,若出气导管口有气泡冒出,松手或拿走热毛巾后导管内回升一段水柱,证明A装置不漏气。(2分)
Ⅱ、ACBECF(2分);
Ⅲ、①氢氧化钠遇水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。(2分)
②4NH3十5O2 4NO+6H2O(2分)③说明氨的氧化反应是一个放热反应(2分)
4NO+6H2O(2分)③说明氨的氧化反应是一个放热反应(2分)
24、(13分)
Ⅰ(4分)(1)S2―>O2―>Na+ (2)SO2+Cl2+2H2O=2HCl+H2SO4(每空2分)
Ⅱ(4分)(1)Ag++e― =Ag,2H++2e―=H2↑ (2)2.24L(每空2分)
Ⅲ(2分)C(s)+O2(g)=CO2(g) △H=-393.5kJ?mol―1
Ⅳ NaNO2(1分) 8 (2分)
25、(每空2分,共14分)
(1)Cl2+2OH-=Cl-+ClO-+H2O w.w.w.k.s.5 u.c.o.m;(2)C、浓H2SO4
(3)MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O;(4)Na2SO4、O2
Mn2++Cl2↑+2H2O;(4)Na2SO4、O2
(5)AlCl3 NaAlO 2
2
(6)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O[或3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O]
30、(共12分)
(1)1s22s22p63s23p63d84s2 (2分) (2) C≡O (2分) (3) 分子晶体(2分) 配位键(共价键)(2分) (4)MgCNi3 (2分) 12个(2分)
31、(共12分)(1) (2) (a) 消去反应 (b)
(2) (a) 消去反应 (b) 
(c) F中含碳碳双键,羟基氧化时可能会同时氧化碳碳双键,使最终不能有效、顺利地转化为B
(d)⑥
⑦
2009届安溪县高三年理综统练生物试卷参考答案
命题:黄文坚
1-5:CACBC
26.(每空2分,共24分)
 Ⅰ(14分)Aa1、a1a2、a2a2 (2)1/4 , 1/2
(3)2/3 (4)(6分,亲代表现型和后代表现型,以及表现型之比、亲代和子代基因型,配子各1分)
Ⅰ(14分)Aa1、a1a2、a2a2 (2)1/4 , 1/2
(3)2/3 (4)(6分,亲代表现型和后代表现型,以及表现型之比、亲代和子代基因型,配子各1分)
II、(10分)基因库 64% (2)自然选择 (3)发生了进化,因为只要种群基因频率改变,就是在进化;(4)没有产生新物种,只是种群基因频率改变,并没有产生生殖隔离。
27.(共16分)(1)温度、氧浓度、水分(2分)
(2)细胞中原来就存在这些特殊蛋白质基因,春化作用(低温处理)激活了这些基因(2分)
(3)细胞分化(2分)特定基因表达或抑制(2分)
(4)选取粒大饱满的冬小麦种子若干,浸种并使其萌芽,配制不同浓度梯度的赤霉素溶液。(2分)
对照组:冬小麦幼苗10株,不经低温和赤霉素处理(2分)
实验组A:冬小麦幼苗10株,低温处理(2分)
实验组B:不经低温,然后用不同浓度梯度的赤霉素溶液处理,每种浓度的赤霉素溶液处理10株冬小麦幼苗。(2分)(其它如表格形式等合理答案也可)
32.(共10分)(1) ①目的基因的检测与表达 ②DNA聚合 ③脱分化(1分) 再分化(1分) ④ABC (2)筛选和检测
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com