
题目列表(包括答案和解析)
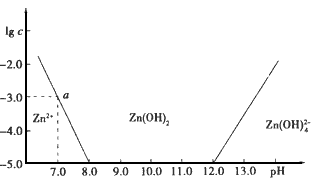

如图:横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42-离子(配离子)物质的量浓度的对数,回答下列问题.
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为___________
(2)从图中a点数据计算可得Zn(OH)2的溶度积Ksp值为___________.
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是_____.
(4)往1 L 1.00 mol/L ZnCl2溶液中加入NaOH固体至pH=6,根据(2)中求得的Ksp值或根据图像中的关系,可求得需NaOH________mol.
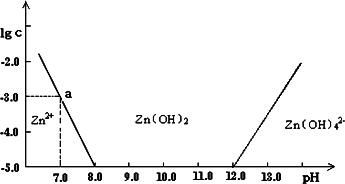
如图:横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题.
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:________.
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)![]() ________.
________.
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________.
(4)往1.00 L 1.00 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH________mol
(5)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
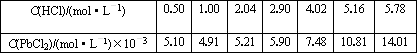
根据上表数据判断下列说法正确的是________(填字母序号)
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
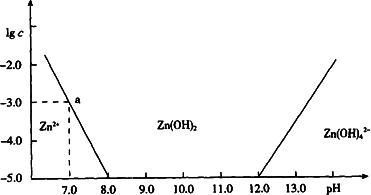
(10分)如图横坐标为溶液的pH值,纵坐标为Zn2+ 离子或Zn(OH)42-离子(配离子)物质的量浓度的对数,回答下列问题.

(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为 。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)= 。
(3)某废液中含Zn2+ 离子,为提取Zn2+ 离子可以控制溶液中pH值的范围是 。
(4)往1L 1.00 mol?L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH mol (精确到小数点后2位)。
(5)25℃时,PbCl2固体在盐酸中的溶解度如下:
c(HCl)/ (mol?L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
103 c(PbCl2)/ (mol?L-1) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是 。
![]() A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
![]() B.PbCl2固体在0.50 mol?L-1盐酸中的溶解度小于在纯水中的溶解度
B.PbCl2固体在0.50 mol?L-1盐酸中的溶解度小于在纯水中的溶解度
![]() C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(配离子)
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(配离子)
![]() D.PbCl2固体可溶于饱和食盐水
D.PbCl2固体可溶于饱和食盐水
如图所示,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42—离子物质的量浓度的对数,回答下列问题。
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
(4)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
| c(HCl)/( mol·L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| c(PbCl2)/( mol·L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com