(2012?顺义区二模)部分中学化学常见元素原子结构、性质及用途如下表:
| 序号 |
元素 |
结构及性质 |
| ① |
A |
A的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| ② |
B |
B原子最外层电子数是内层电子总数的 |
| ③ |
C |
C的氧化物是两性氧化物,且作为耐火材料 |
| ④ |
D |
A、D、E组成的36电子的化合物甲是家用消毒剂的主要成分 |
| ⑤ |
E |
通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ |
F |
F元素最高正价与最低负价的代数和为4 |
请用化学用语回答下列问题:
(1)按A、B、C顺序,三种元素的金属性逐渐
减弱
减弱
;用原子结构解释其原因
Na、Mg、Al电子层数相同,核电荷数的递增,原子半径逐渐减小,原子核吸引电子能力增强,金属性减弱
Na、Mg、Al电子层数相同,核电荷数的递增,原子半径逐渐减小,原子核吸引电子能力增强,金属性减弱
.
(2)一定条件下,将4.0mol FE
2和3.0mol E
2 通入到体积为 2L的密闭容器中.反应达到平衡时,容器中为FE
2 0.4mol,则此反应的平衡常数是.改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是
ad
ad
(填字母).
a.增大压强 b.降低温度 c.使用催化剂 d.增大反应物的浓度
(3)E与氢元素可以形成原子个数比分别为1:2、1:1的两种化合物X和Y.
| 实验编号 |
温度/℃ |
加入试剂 |
加入Y的量 |
| ① |
5 |
2滴 1mol/L FeCl3溶液 |
4mL 10% 的Y溶液 |
| ② |
40 |
2滴1mol/L FeCl3溶液 |
4mL 10% 的Y溶液 |
| ③ |
40 |
2滴1mol/L FeCl3溶液
2mL X |
|
欲探究温度对Y分解速率的影响,应选择
①②
①②
组实验;欲探究Y的浓度对分解速率的影响,请填写相关数据.
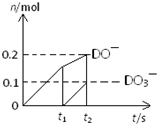
(4)一定量的石灰乳中通入一定量的D单质,两者恰好完全反应,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t
2时刻消耗氢氧化钙质量为
37g
37g
g,此时反应的方程式为
10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O
10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O
.

