
题目列表(包括答案和解析)
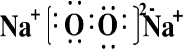
| ||
| ||
铁是日常生活中最常见的金属,某班同学在学习铁的知识时,有下列问题:
问题1:铁为何称为黑色金属?
问题2:CuO在高温下可分解为 Cu2O和O2,Fe2O3在高温下可分解为FeO和O2吗?
(1)对于问题1,同学们上网查找,有两种解释:
A.因为在铁表面上有黑色的铁的氧化物,所以叫黑色金属
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属
①你认为正确的说法是__________。
②若有一黑色粉末,如何鉴别是铁粉,还是Fe3O4?______________________________________。
③若有一黑色粉末,为铁和四氧化三铁的混合物,如何证明其中有Fe3O4(只要求简述实验方法)?____________________________________。
(2)对于问题2,同学们准备实验探究,他们设想了两种方法:
A.将三氧化二铁高温灼烧,看灼烧前后颜色是否变化。
B.将三氧化二铁高温灼烧,看灼烧前后质量是否变化。
①实验中应将Fe2O3放在__________(填仪器名称)中灼烧。
②方法A中,如果高温灼烧后颜色由__________变为__________,说明Fe2O3确实发生了变化。能说明生成的一定为FeO吗?__________,理由是________________________。
③方法B中,如果发生了预期的反应,固体高温灼烧前后质量比应为________,但是,实验结果固体灼烧前后质量比为30∶29,则高温灼烧后生成物是____________________。
④比较两种方法,你认为较好的方法是__________。
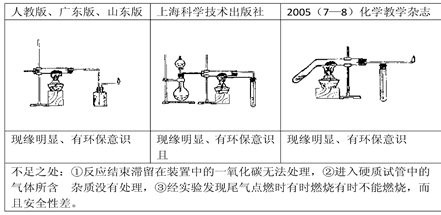
 CO↑+H2O 请根据以下各图进行选择形成一套相对较为合理的实验装置图(某些装置可重复使用)
CO↑+H2O 请根据以下各图进行选择形成一套相对较为合理的实验装置图(某些装置可重复使用) 
铁是日常生活中最常见的金属,某班同学在学习铁的知识时,有下列问题:
问题1:铁为何称为黑色金属?
问题2:CuO在高温下可分解为Cu2O和O2,Fe2O3在高温下可分解为FeO和O2吗?
(1)对于问题1,同学们上网查找,有两种解释:
A.因为在铁表面有黑色的铁的氧化物,所以叫黑色金属
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属
①你认为正确的说法是____________。
②若有一黑色粉末,如何鉴别是铁粉,还是Fe3O4粉末:
____________ 。
③若有一黑色粉末,为铁和四氧化三铁的混合物,如何证明其中有Fe3O4(只要求简述实验方法):____________ 。
(2)对于问题2,同学们准备实验探究,他们设想了两种方法:
A.将三氧化二铁高温灼烧,看灼烧前后颜色是否变化
B.将三氧化二铁高温灼烧,看灼烧前后质量是否变化
①实验中应将Fe2O3放在____________(填仪器名称)中灼烧。
②方法A中,如果高温灼烧后颜色由____________变为____________ ,
说明Fe2O3确实发生了变化。能说明生成的一定为FeO吗?____________(填“能”或“不能”)。理由是____________。
③方法B中,如果发生了预期的反应,固体高温灼烧前后质量比应为____________,但是,实验结果是固体灼烧前后质量比为30∶29,则高温灼烧后生成物是____________。
④比较两种方法,你认为较好的方法是____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com