
题目列表(包括答案和解析)
配制一定物质的量浓度溶液是一个重要的定量实验。请回答以下问题:
(1)要配制浓度约为2 mol·L-1的NaOH溶液100mL,下列操作正确的是
A.称取8gNaOH固体,放入250mL烧杯中,用量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8gNaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水至刻度线WWW.K**S*858$$U.COM,盖好瓶塞,反复摇匀
D.用100mL量筒称取40mL 5mol·L-1的NaOH溶液,倒入250mL烧杯中,再用同一量筒量取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
(2)下列操作使配制的BaCl2溶液浓度偏低的是
A.未洗涤烧杯和玻璃棒 B.选用的容量瓶内有少量蒸馏水
C.有少量洗涤液未能全部转移到容量瓶中
D.定容摇匀后,液面下降,又加水至刻度线
(3)某实验中需要2mol·L-1的Na2CO3溶液950mL,配制时应选用容量瓶的规格为 ,称取固体Na2CO3的质量为 。
配制一定物质的量浓度溶液是一个重要的定量实验。请回答以下问题:
(1)要配制浓度约为2 mol·L-1的NaOH溶液100mL,下列操作正确的是
A.称取8gNaOH固体,放入250mL烧杯中,用量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8gNaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水至刻度线WWW.K**S*858$$U.COM,盖好瓶塞,反复摇匀
D.用100mL量筒称取40mL 5mol·L-1的NaOH溶液,倒入250mL烧杯中,再用同一量筒量取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
(2)下列操作使配制的BaCl2溶液浓度偏低的是
A.未洗涤烧杯和玻璃棒 B.选用的容量瓶内有少量蒸馏水
C.有少量洗涤液未能全部转移到容量瓶中
D.定容摇匀后,液面下降,又加水至刻度线
(3)某实验中需要2mol·L-1的Na2CO3溶液950mL,配制时应选用容量瓶的规格为 ,称取固体Na2CO3的质量为 。
配制一定物质的量浓度溶液是一个重要的定量实验。请回答以下问题:
(1)要配制浓度约为2 mol·L-1的NaOH溶液100mL,下列操作正确的是
A.称取8gNaOH固体,放入250mL烧杯中,用量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8gNaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水至刻度线WWW.K**S*858$$U.COM,盖好瓶塞,反复摇匀
D.用100mL量筒称取40mL 5mol·L-1的NaOH溶液,倒入250mL烧杯中,再用同一量筒量取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
(2)下列操作使配制的BaCl2溶液浓度偏低的是
A.未洗涤烧杯和玻璃棒 B.选用的容量瓶内有少量蒸馏水
C.有少量洗涤液未能全部转移到容量瓶中
D.定容摇匀后,液面下降,又加水至刻度线
(3)某实验中需要2mol·L-1的Na2CO3溶液950mL,配制时应选用容量瓶的规格为 ,称取固体Na2CO3的质量为 。
准确配制某体积的0.25 mol/L的NaOH溶液,试回答下列问题:
(1)A学生准确计算出需要NaOH固体的质量为5.0 g ,实验所用仪器中的定量仪器除了天平、量筒和烧杯以外,另一个重要的定量仪器是 。
(2) 配制方法:某同学设计了四个操作步骤:
①向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温。
②将NaOH溶液沿玻璃棒注入500 mL容量瓶中。
③继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm。
④改用 (填仪器名称)加蒸馏水至液面与刻度线相切,加盖摇匀。
若按上述步骤配制溶液物质的量浓度会________(填“偏高”或“偏低”或“无影响”)。若无影响下面不用填写,若有影响,应在步骤________________之间,补充的操作是__________________________________________________________________________________。
酸碱中和反应是中学化学一类重要的反应,其反应的本质都是H+和OH-反应生成H2O.某学生实验小组对课本中的两个酸碱中和实验进行了模拟研究.
(1)用下图装置进行强酸(50 mL 0.5 mol/L的HCI)和强碱(50 mL 0.55 mol/L的NaOH)反应的中和热测定.
①从实验装置上看,图中尚缺少的一种玻璃仪器是________;
②大小烧杯之间填满纸屑的作用是________;
③向组装好的量热器中加入50 mL盐酸并测定温度,取出温度计并冲
净后,再将已测定好温度的NaOH溶液50 mL加入量热器.下列加入50 mL NaOH溶液的操作正确的是________.
A.为了使酸碱充分中和,必须边滴加NaOH溶液边迅速搅拌
B.把50 mL NaOH溶液一次迅速倒入,盖上纸板迅速搅拌.
④若用醋酸代替上述盐酸实验,实验测得的中和热值________(填偏大、偏小或无影响).
(1)、用实验室准确配制的0.100 mol/L的NaOH溶液测定某未知浓度的稀盐酸.
其具体实验步骤如下:
①取一支碱式滴定管下图中有两只滴定管~上端未画出,你选择哪一只?________(填写对应字母),用少量标准NaOH溶液润洗2~3次水洗后的碱式滴定管,再加入标准的0.100 mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00 mL待测盐酸,置于用蒸馏水洗净的锥形瓶中,再加入酚酞(变色范围:8.2~10.0)试液2滴;
③滴定时,边滴边振荡,同进注视眼睛注视锥形瓶内容也颜色的变化,当锥形瓶内溶液由________(填写颜色变化)且半分钟内不褪色时,即达到滴定终点;
④记录液面刻度读数.根据滴定管的两次读数得出消耗标准盐酸的体积,再重复测定两次,实验结果记录见下表:
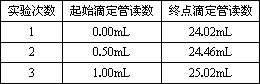
测得未知稀盐酸的物质的量浓度为________(保留小数点后3位).
⑤如果滴定结束时俯视碱式滴定管刻度读数(其它操作均正确),则对滴定结果~稀盐酸浓度的影响是________(填“偏高”、“偏低”或“无影响”).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com