
题目列表(包括答案和解析)
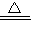 2ClO2↑+K2SO4+2CO2↑+2H2O,标况下制得气体为1.12L
2ClO2↑+K2SO4+2CO2↑+2H2O,标况下制得气体为1.12L 2ClO2↑+K2SO4+2CO2↑+2H2O,标况下制得气体为1.12L
2ClO2↑+K2SO4+2CO2↑+2H2O,标况下制得气体为1.12L把图b中的物质补充到图a中,可得到一个完整的氧化还原型离子方程式(未配平).对该氧化还原型离子方程式说法不正确的是

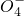 作氧化剂
作氧化剂


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com