
题目列表(包括答案和解析)
请回答下列问题:
(1)HgS与O2的反应中,氧化剂是____________,每生成1 mol Hg转移电子的物质的量为____________ mol。
(2)电解某汞的硝酸盐溶液,当阴极消耗a mol金属阳离子时,可获得
(3)随着冶炼、电镀等工业生产的不断发展,所需汞及其化合物的用量也日趋增多,随之排放出来的含汞的废水也愈加严重,现已成为世界上危害较大的工业废水之一。以下处理含汞(Hg2+)废水的方法中最简单实用的是____________(填序号)。
A.向含Hg2+的废水中加入Na2S等可溶性硫化物
B.加入金属还原剂
C.电解法
 Hg+SO2),是因为会产生二氧化硫污染
Hg+SO2),是因为会产生二氧化硫污染 反应Ⅰ HgS+O2![]() Hg+SO2
Hg+SO2
反应Ⅱ 4HgS+4CaO![]() 4Hg+3CaS+CaSO4
4Hg+3CaS+CaSO4
(1)反应Ⅰ中,还原产物是_______,每生成1个SO![]() 分子,转移电子数为________。
分子,转移电子数为________。
(2)反应Ⅱ中,HgS是_________(填“氧化剂”“还原剂”),用双线桥法标出反应Ⅱ中电子转移的方向和数目。
Ⅰ.氧化还原反应有多种分类方法,其中根据参与电子转移的元素种类不同的分类方法最常见。下列反应中电子转移发生在相同价态的同种元素之间的有 (填反应编号,下同);电子转移发生在不同价态的同种元素之间的有 ;电子转移发生在不同元素之间的有 。
①Fe+2FeCl3===3FeCl2 ②NH4NO3 N2O↑+2H2O
N2O↑+2H2O
③2KMnO4 K2MnO4+MnO2+O2
↑ ④S+2KNO3+3C
K2MnO4+MnO2+O2
↑ ④S+2KNO3+3C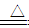 K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
⑤Cl2+2NaOH===NaCl+NaClO+H2O ⑥HgS+O2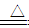 Hg+SO2
Hg+SO2
Ⅱ.氧化还原反应必定遵循一定的价态规律。若用字母L、M、Q、R、X分别代表五种含不同化合价的氮元素的物质,并且每种物质中氮元素的化合价只有一种。又知道物质L中氮元素的化合价要比物质M中氮元素的化合价低,并且在一定条件下,它们会有如下的相互转换关系(未配平):
① Q + HCl→ M+Cl2 ② R+L→ X+ H2O ③ R+O2 → L+ H2O
(1)已知这五种物质中有一种是硝酸,那么硝酸应该是L、M、Q、R、X中的_______ 。(填字母)
(2)NH4NO3在不同条件(温度)下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应。若NH4NO3在通常条件下加热的分解产物不出下列范围,根据已学知识判断,下列反应(未配平)中属于氧化还原反应且可能发生的有 。(填反应编号)
A.NH4NO3→N2+O2+H2O B.NH4NO3→NH3+HNO3
C.NH4NO3→O2+HNO3+H2O D.NH4NO3→N2+HNO3+H2O
E.NH4NO3→N2+NH3+H2O F.NH4NO3→N2O+H2O
反应Ⅰ HgS+O2![]() Hg+SO2
Hg+SO2
反应Ⅱ 4HgS+4CaO![]() 4Hg+3CaS+CaSO4
4Hg+3CaS+CaSO4
请试完成下列问题:
(1)HgS与氧气反应,氧化剂是______________。
(2)请标出反应Ⅱ中电子转移的方向和数目:______________。
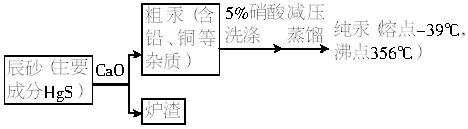
(3)得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式:__________________________________________。
(4)已知Hg(NO3)2溶液中加入Hg,存在如下平衡:Hg+Hg2+![]()
![]() ,提高
,提高![]() 浓度的方法是______________。
浓度的方法是______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com