
题目列表(包括答案和解析)
(12分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH1=-99 kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH1=-99 kJ·mol-1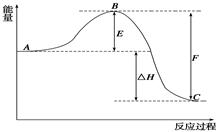
请回答下列问题:
(1)该反应属于________反应(填“放热”或“吸热”)。
(2)图中C表示 。
(3)从化学键的角度分析,F代表什么意义?F ;
(4)改变反应条件可改变E值大小,如加入V2O5作催化剂,可使E值减小。E的大小对该反应的反应热有 。(无影响、有影响、不确定)
(5)图中ΔH=________kJ·mol-1。
(6)若已知1 mol SO2(g)氧化为1 mol SO3(l)的ΔH2=-Q kJ·mol-1,则ΔH1______ΔH2(填“>”、“<”或“=”)。
2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示.已知1 mol SO2(g)氧化为1 mol SO3(g)的△H1=-99 kJ·mol-1
2SO3(g)反应过程的能量变化如图所示.已知1 mol SO2(g)氧化为1 mol SO3(g)的△H1=-99 kJ·mol-1
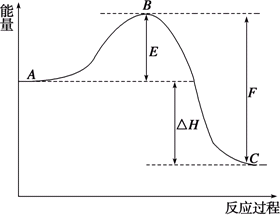
请回答下列问题:
(1)该反应属于________反应(填“放热”或“吸热”).
(2)图中C表示________.
(3)从化学键的角度分析,F代表什么意义?F________;
(4)改变反应条件可改变E值大小,如加入V2O5作催化剂,可使E值减小.E的大小对该反应的反应热有________.(无影响、有影响、不确定)
(5)图中ΔH=________kJ·mol-1.
(6)若已知1 mol SO2(g)氧化为1 mol SO3(l)的ΔH2=-Q kJ·mol-1,则ΔH1________ΔH2(填“>”、“<”或“=”).
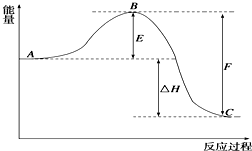 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1(13分)在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定条件下发生如下反应: H2(g) + I2(g) 2HI(g) △H = Q(Q<0)反应中各物质的浓度随时间变化情况如图1
2HI(g) △H = Q(Q<0)反应中各物质的浓度随时间变化情况如图1
(1)根据图1数据,反应开始至达到平衡时,平均速度v(HI)为 。
(2)反应达到平衡后,第8分钟时:①该反应的平衡常数表达式:K = ;若升高温度,化学平衡常数K (填“增大”、“减小”或“不变”),HI浓度的变化正确的是 (用图2中a ~ c的编号回答)。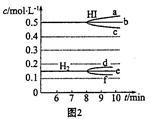
② 若加入I2,H2浓度的变化正确的是 (用图2中d ~ f的编号回答)。
(3)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍, 请在图3中画出8分钟后HI浓度的变化情况。
(13分)在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6
mol的I2,在一定条件下发生如下反应: H2(g) + I2(g) 2HI(g) △H =
Q(Q<0)反应中各物质的浓度随时间变化情况如图1
2HI(g) △H =
Q(Q<0)反应中各物质的浓度随时间变化情况如图1
(1)根据图1数据,反应开始至达到平衡时,平均速度v(HI)为 。

(2)反应达到平衡后,第8分钟时:① 该反应的平衡常数表达式:K = ;若升高温度,化学平衡常数K (填“增大”、“减小”或“不变”),HI浓度的变化正确的是 (用图2中a ~ c的编号回答)。

② 若加入I2,H2浓度的变化正确的是 (用图2中d ~ f的编号回答)。
(3)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍, 请在图3中画出8分钟后HI浓度的变化情况。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com