
题目列表(包括答案和解析)
图1-5
请回答:
(1)经测定,有机物J中碳、氢元素质量分数依次为40.68%、5.08%,其余为氧元素。J对H2的相对密度是59。写出J的分子式:_______________________。
(2)写出下列物质的结构简式:E_________________________C_____________________。
(3)简述配制银氨溶液的操作:_____________________________________________。
(4)写出下列化学反应方程式,并注明反应类型。
G+I![]() J__________________________________,类型:___________________。
J__________________________________,类型:___________________。
H![]() I__________________________________,类型:___________________。
I__________________________________,类型:___________________。
(5)写出一种属于酯类,且与J互为同分异构体的结构简式:_____________________________。
氨 水
氨水是无色液体,工业和农业用的氨水,常因含有铁离子等杂质而显浅黄色。氨水有强烈刺激性气味,对眼睛黏膜有强烈的刺激性,对伤口有腐蚀性。
氨水的密度小于纯水的密度,最浓的氨水中NH3的质量分数为35.28%,密度为
氨水在医疗上用于治疗昏厥和外用消毒等,也是家庭中常用的清洁剂。
思考:(1)质量分数为35%的氨水,与等体积的水混合后所得溶液的质量分数为
B.大于17.5%
C.小于17.5%
D.无法确定
(2)根据氨水的性质,在农作物施用氨水作氮肥时应如何施用?
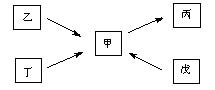 甲 、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如右图所示。
甲 、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如右图所示。
(1)若R为一种非金属元素,且上述五种物质含有不同的官能团,丁为带水果香味的液体,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下相对H2的密度为14,则由甲在一定条件下生成戊的化学方程式为 ,欲检验乙中官能团,所选用的试剂为(填序号) 。
① NaOH溶液 ② Br2的CCl4溶液 ③银氨溶液 ④ AgNO3溶液 ⑤ 稀HNO3
(2)若R为另一种非金属元素,甲与丙为常见大气污染物,且甲与丙的相对分子质量相差16。乙在常温下为气体,丁为空气的主要成分之一。则丁的电子式为 ,乙的空间构型为 ;戊的稀溶液能跟过量铁粉反应,其离子方程式为 。
(3)若R为一种金属元素,乙由两种元素组成,甲溶液的pH小于7,单质丁在一定条件下可生成戊。甲与戊两种溶液混合生成沉淀丙的离子方程式为 ,除去镁粉中混有少量的丁,涉及的离子方程式为 。
甲、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如右图所示。
|
不同的官能团,丁为带水果香味的液体,乙和丁
均能在碱性条件下生成甲,戊是一种无色气体,
相同条件下相对H2的密度为14。写出由甲生成
戊的化学方程式 ,
欲检验乙中官能团,所选用的试剂为(填序号) 。
①NaOH溶液 ②Br2的CCl4溶液 ③银氨溶液 ④AgNO3溶液
⑤稀HNO3
(2)若R为另一种非金属元素,甲与丙为常见大气污染物,且甲与丙的相对分子质量相差16。丁为空气的主要成分之一。则丁的电子式为 ,乙的空间构型为 ,戊的稀溶液能跟过量铁粉反应,其离子方程式为 。
(3)若R为一种金属元素,甲溶液的pH小于7,乙由两种元素组成,单质丁在一定条件下可生成戊。甲与戊两种溶液混合能生成沉淀丙,其离子方程式为 ,若镁粉中混有少量的丁,除去丁的离子方程式为 。
(1)下列说法正确的是____________(选填序号)。
A.在进行物质检验时,一般先对试样进行外观观察,确定其状态、颜色、气味等
B.配制银氨溶液时,应把硝酸银溶液逐滴加入氨水中
C.一般在实验室点燃可燃性气体时,必须先检验纯度
D.测定硫酸铜晶体结晶水的质量分数时,若用潮湿的坩埚会使测定结果偏小
E.酸碱中和滴定实验中根据碱式滴定管的两次读数得出NaOH溶液体积为22.0 mL
F.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
(2)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01 mol·L-1到0.008 mol·L-1等一系列浓度的[Fe(SCN)6]3-(红色)溶液作为标准比色液。
②样品处理:
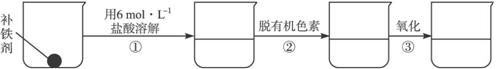
③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10 mL。
④比色:选取与待测液颜色一致或相近的标准比色液即可判断待测液的浓度。
试回答下列问题:
①配制100 mL 0.01 mol·L-1标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:_______________、_______________。
②步骤②脱色过程包括加入____________(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→____________(填操作)。
③步骤②样品处理中,氧化的目的是______________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com