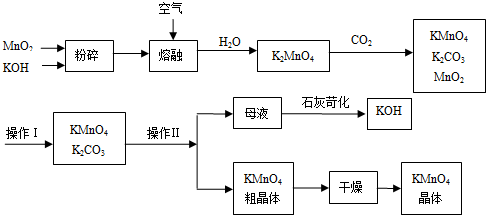
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N
2和H
2为原料合成氨气.反应N
2(g)+3H
2(g)?2NH
3(g)△H<0
①下列措施可以提高H
2的转化率是(填选项序号)
.
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH
3 d.升高温度
②一定温度下,在密闭容器中充入1molN
2和3molH
2发生反应.若容器容积恒定,达到平衡状态时,容器内的压强是原来的
,则N
2的转化率a
1=
;
若容器压强恒定,达到平衡状态时,N
2的转化率为a
2,则a
2
a
1(填“>”、“<”或“=”).
(2)以氨气、空气为主要原料制硝酸.
①NH
3被氧气催化氧化生成NO的反应的化学方程式是
.
②在容积恒定的密闭容器中进行反应2NO(g)+O
2(g)?2NO
2(g)△H>0
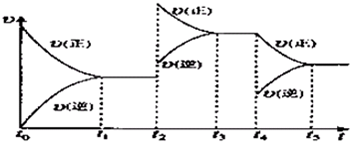
该反应的反应速率(v)随时间(t)变化的关系如图所示.若t
2、t
4时刻只改变一个条件,下列说法正确的是(填选项序号)
.
a.在t
1~t
2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t
2时,采取的措施一定是升高温度
c.在t
3~t
4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t
0~t
5时,容器内NO
2的体积分数在t
3时值的最大
③向容积相同、温度分别为T
1和T
2的两个密闭容器中分别充入等量NO
2发生反应:
2NO
2 (g)?N
2O
4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO
2的百分含量分别为a
1,a
2.已知T1<T2,则a
1
a
2 A.大于 B.小于 C.等于 D.以上都有可能
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H
2将NO
2还原为N
2.
已知:2H
2(g)+O
2(g)=2H
2O(g)△H=-483.5kJ/mol
N2(g)+2O
2(g)=2NO
2(g)△H=+133kJ/mol
则H
2还原NO
2生成水蒸气反应的热化学方程式是
.
②碱液吸收法:用Na
2CO
3溶液吸收NO
2生成CO
2.
若每9.2gNO
2和Na
2CO
3溶液反应时转移电子数为0.1mol,则反应的离子方程式是
.