
题目列表(包括答案和解析)
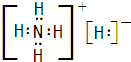
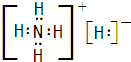
| ||
| ||
 ?
?
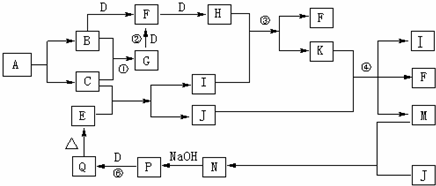
(1)在实验室用集气瓶收集气体G和气体H。则收集气体G的方法是 ,检验气体H已收集满的方法是 。?
(2)在实验室进行操作①时,除了使用酒精灯、铁架台、铁圈及夹持仪器外,还缺少的玻璃仪器是 ,在进行操作②时,应在HCl的气氛中加热脱水,其目的是 。?
(3)F位于元素周期表第? ?周期? ?族,写出其最高价氧化物对应的水化物的电子式? ?。写出反应A+H2O→B+H的化学方程式 。?
(4)某学生设计如图15-38装置,将产生的气体H通入硫酸铜溶液,制得深蓝色溶液J。现有下列?试剂?:?
 ?
?
图15-38
①稀NaOH溶液 ②H2O2溶液 ?③浓氨水 ?④NH4Cl?溶液 ⑤生石灰 ?⑥消石灰 ⑦碳酸氢钠?
(Ⅰ)a中的试剂:固体X应是? ?(填序号),溶液Y应是 (填序号)。
(Ⅱ)你认为使用装置b时存在的主要缺点: (用简明文字叙述)。?
根据实验要求,回答下列问题:
(1)精制硫酸亚铁晶体(含少量不溶性杂质)时,将晶体溶于水后,为什么还需加热到50℃~80℃?为减少硫酸亚铁的损失,应采取什么分离方法?
(2)某溶液中含有OH-、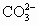 、
、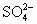 三种阴离子,要求只取一次待测液就能将阴离子都检验出来,试设计一种简便的检验方法(不选用指示剂).
三种阴离子,要求只取一次待测液就能将阴离子都检验出来,试设计一种简便的检验方法(不选用指示剂).
(16分)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置(图3)。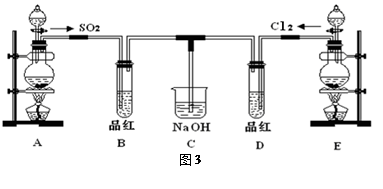
(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:________________________________,D:____________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:________________________________,D:____________________________。
(2)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)______________________________ 。
(3)装置E中用MnO2和浓盐酸反应制得Cl2,若反应生成的Cl2体积为2.24L(标准状况),则被氧化的HCl为 mol。
(4)实验结束后,有同学认为装置C中可能含有SO32-、SO42-、Cl-、OH-等阴离子,请填写检验其中SO42-和SO32-的实验报告。
限选试剂:2 mol·L-1 HCl;1 mol·L-1 H2SO4;l mol·L-1 BaCl2;l mol·L-1MgCl2
1 mol·L-1 HNO3;0.1 mol·L-1 AgNO3;新制饱和氯水。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液于试管中,滴入 至过量 | ,证明待测液中含SO32-。 |
| 步骤② | 在步骤①的溶液中滴入少量 | , 证明待测液中含SO42-。 |
(16分)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置(图3)。
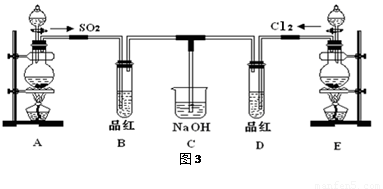
(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:________________________________,D:____________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:________________________________,D:____________________________。
(2)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)______________________________ 。
(3)装置E中用MnO2和浓盐酸反应制得Cl2,若反应生成的Cl2体积为2.24L(标准状况),则被氧化的HCl为 mol。
(4)实验结束后,有同学认为装置C中可能含有SO32-、SO42-、Cl-、OH-等阴离子,请填写检验其中SO42-和SO32-的实验报告。
限选试剂:2 mol·L-1 HCl;1 mol·L-1 H2SO4;l mol·L-1 BaCl2;l mol·L-1MgCl2
1 mol·L-1 HNO3;0.1 mol·L-1 AgNO3;新制饱和氯水。
|
编号 |
实验操作 |
预期现象和结论 |
|
步骤① |
取少量待测液于试管中,滴入 至过量
|
,证明待测液中含SO32-。 |
|
步骤② |
在步骤①的溶液中滴入少量
|
, 证明待测液中含SO42-。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com