
题目列表(包括答案和解析)
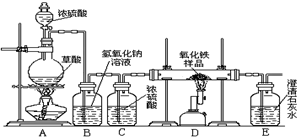 化学小组的同学在研究性学习课上展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应,且杂质中不含铁).查阅资料:草酸在浓硫酸存在时加热发生如下反应:
化学小组的同学在研究性学习课上展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应,且杂质中不含铁).查阅资料:草酸在浓硫酸存在时加热发生如下反应:
| ||
| △ |
| ||
| ||
 化学小组的同学在研究性学习课上展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应,且杂质中不含铁).查阅资料:草酸在浓硫酸存在时加热发生如下反应:
化学小组的同学在研究性学习课上展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应,且杂质中不含铁).查阅资料:草酸在浓硫酸存在时加热发生如下反应: CO↑+CO2↑+H2O
CO↑+CO2↑+H2O 化学是研究物质组成、结构、性质及其变化规律的科学.请回答下列问题:
化学是研究物质组成、结构、性质及其变化规律的科学.请回答下列问题:
某研究性学习小组设计了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案.请回答下列问题:
小资料:碱石灰的主要成分是氢氧化钠和氧化钙的混合物
(1)气体法。
【原理思路】利用Na2CO3与稀硫酸反应产生CO2,通过测量丙装置实验前后的质量得出CO2质量,从而计算碳酸钠的质量分数。(不考虑原装置内空气的影响)
【实验分析】小科同学根据以上思路,设计了如下图的实验装置。
①实验装置乙中盛放的试剂为 。
装置丁中碱石灰的作用是 。(填字母)
A.吸收Na2CO3与稀硫酸反应产生CO2
B.防止外界空气中二氧化碳进入丙中
C.干燥二氧化碳
②实验中如果滴加稀硫酸的速度过快,会导致测得样品中碳酸钠的
质量分数 (填写“偏高”“偏低”或“不变”).
③小明同学认为小科的方案存在问题,即使操作规范下也会造成结果偏低,你认为他的理由是 ,应该将装置甲中双孔橡胶塞换成三孔橡胶塞,并增加下图装置,实验结束后缓缓通入一段时间空气,目的是 ,其中NaOH溶液的作用是 。
(2)沉淀法.
【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数。
【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;
②加入过量的CaCl2溶液充分反应。证明CaCl2过量(即Na2CO3已完全反应)的方法是: 静置,向上层清液中滴加 溶液,如果没有白色沉100%=96.4%淀生成,证明CaCl2过量;
③过滤、操作X、干燥、称量沉淀的质量为10.0g,操作X的名称是 ,如果缺少此操作会造成碳酸钠质量分数 (填写“偏高”“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数为 。(写出计算过程,结果保留至0.1%)
某研究性学习小组设计了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案.请回答下列问题:
小资料:碱石灰的主要成分是氢氧化钠和氧化钙的混合物
(1)气体法。
【原理思路】利用Na2CO3与稀硫酸反应产生CO2,通过测量丙装置实验前后的质量得出CO2质量,从而计算碳酸钠的质量分数。(不考虑原装置内空气的影响)
【实验分析】小科同学根据以上思路,设计了如图1的实验装置。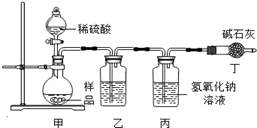
图1
①实验装置乙中盛放的试剂为 ,
其作用是 ;
装置丁中碱石灰的作用是 。(填字母)
A.吸收Na2CO3与稀硫酸反应产生CO2
B.防止外界空气中二氧化碳进入丙中
C.干燥二氧化碳
②实验中如果滴加稀硫酸的速度过快,会导致测得样品中碳酸钠的
质量分数 (填写“偏高”“偏低”或“不变”).
③小明同学认为小科的方案存在问题,即使操作规范下也会造成结果偏低,你
认为他的理由是 ,应该将装置甲中双孔橡
胶塞换成三孔橡胶塞,并增加图2装置,实验结束后缓缓通入一段时间空气,
目的是 ,其中NaOH溶液的作用是 。
图2
(2)沉淀法.
【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数。
【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;
②加入过量的CaCl2溶液充分反应。证明CaCl2过量(即Na2CO3已完全反应)的方法是: 静置,向上层清液中滴加 溶液,如果没有白色沉淀生成,证明CaCl2过量;
③过滤、操作X、干燥、称量沉淀的质量为10.0g,操作X的名称是 ,如果缺少此操作会造成碳酸钠质量分数 (填写“偏高”“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数为 。(写出计算过程,结果保留至0.1%,共3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com