
题目列表(包括答案和解析)
Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe304+4CO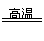 3Fe+4C02,若有1mol
3Fe+4C02,若有1mol
Fe304参加反应,转移电子的物质的量是 mol.
 (2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
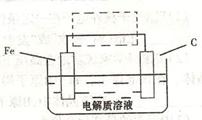
(3)钢铁的电化腐蚀简单示意图如下,将该图稍作修
改即可成为钢铁电化学防护的简单示意图,请在下图虚
线框内作出修改,并用箭头标出电子流动方向。
(4)硫酸亚铁晶体(FeS04·7H20)常作医药上的补血剂。课外研究性小组测定该补血剂中铁元素的含量。实验步骤如下:
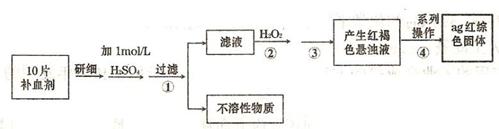
请回答下列问题:
①证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,此过程的现象为:
②若该实验温度下,步骤③中难溶物的溶度积为Ksp=8×l0-38,试计算该物质沉淀完全所需要的pH= (已知溶液中离子浓度小于10-5mol)时,该离子可看做沉淀完全;lg2=0.3)
③步骤④中一系列的操作步骤为:过滤、 、灼烧、冷却、称量。
④若实验过程中无损耗,最后称量得到a克红棕色的固体,则每片补血剂中含铁元素的质
量为 g.(用含a的式子表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com