
题目列表(包括答案和解析)
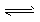 2NH3 ,下列描述能说明反应已达平衡的是
2NH3 ,下列描述能说明反应已达平衡的是 [ ]
| c |
| 2 |
| 3c |
| 2 |
| c |
| 2 |
| 3c |
| 2 |
(10分)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g)2NH3(g) △H <0
(1)该反应450℃的平衡常数 500℃时的平衡常数(填“>”、“<”或“=”);
(2)下列描述中能说明上述反应已达平衡的是
a.3v正(H2)=2v逆(NH3) b.容器中气体的平均相对分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol
计算从反应开始到平衡时,平均反应速率v(N2)为 mol/(L·min)
(4)保持其他条件不变,若初始投入量为a molN2、b molH2 、c molNH3,也可得到与上述相同的平衡,则a、b、c需满足关系式: ;
(5)第5分钟末,保持其它条件不变, 若继续通入0.2 mol的N2和0.6 mol的H2,
则平衡 移动(填“向正反应方向”“向逆反应方向”或“不”)。
(10分)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0
2NH3(g) △H <0
(1)该反应450℃的平衡常数 500℃时的平衡常数(填“>”、“<”或“=”);
(2)下列描述中能说明上述反应已达平衡的是
a.3v正(H2)=2v逆(NH3) b.容器中气体的平均相对分子量不随时间而变化
c.容器中气体的密度 不随时间而变化 d.容器中气体的分子总数不随时间而变化
不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol
计算从反应开始到平衡时,平均反应速率v(N2)为 mol/(L·min)
(4)保持其他条件不变,若初始投入量为amolN2、bmolH2、cmolNH3,也可得到与上述相同的平衡,则a、b、c需满足关系式: ;
(5)第5分钟末,保持其它条件不变, 若继续通入0.2 mol的N2和0.6 mol的H2,
则平衡 移动(填“向正反应方向”“向逆反应方向”或“不”)。
(10分)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0
2NH3(g) △H <0
(1)该反应450℃的平衡常数 500℃时的平衡常数(填“>”、“<”或“=”);
(2)下列描述中能说明上述反应已达平衡的是
a.3v正(H2)=2v逆(NH3) b.容器中气体的平均相对分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol
计算从反应开始到平衡时,平均反应速率v(N2)为 mol/(L·min)
(4)保持其他条件不变,若初始投入量为a molN2、b molH2 、c molNH3,也可得到与上述相同的平衡,则a、b、c需满足关系式: ;
(5)第5分钟末,保持其它条件不变, 若继续通入0.2 mol的N2和0.6 mol的H2,
则平衡 移动(填“向正反应方向”“向逆反应方向”或“不”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com