
题目列表(包括答案和解析)
(1)NaF (2)AlCl3 (3)NO (4)MgO (5)BeCl2 (6)CO2
共价化合物____________________________________________________________。
离子化合物____________________________________________________________。
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
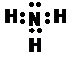
| ||
| ||
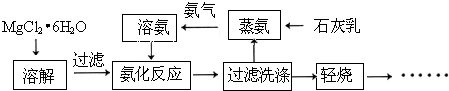
(16分)镁砂(MgO)是一种高温耐火材料。下图是氨法制取高纯镁砂的部分工艺流程:
请回答:
(1)MgCl2•6H2O溶于水,溶液呈 (填“酸性”.“中性”.或“碱性”)。
(2)写出氨分子的电子式 。
(3)蒸氨是将石灰乳通入氯化铵溶液中,并加热,写出该反应的化学方程式: 。
(4)轻烧后的产物为 。
(5)工业获取的MgCl2•6H2O常混有FeCl3,除去MgCl2溶液中的Fe3+,可选用下列试剂
A.MgO B.NaOH C .Mg(OH)2 D .KSCN
(6)氨化反应过程中反应的离子方程式 。
(7)过滤洗涤主要是除去附着在固体表面的氯离子,过滤后洗涤沉淀的方法是 ;
检验沉淀已洗涤干净的方法是 。
氮化硅Si3N4是一种非氧化物高温陶瓷结构材料。粉末状的Si3N4可以由SiCl4的蒸气和NH3气的混合物反应制取。粉末状Si3N4对空气和水都不稳定。但是,将粉末状Si3N4和适量MgO在230×1.01×105Pa和185℃的密闭容器中热处理,可以得到结构十分紧密、对空气和水都相当稳定的固体材料。
(1)写出由SiCl4的蒸气和NH3气制备Si3N4的反应方程式;
(2)分别写出粉末状Si3N4和H2O及O2反应的方程式;
(3)为什么结构紧密的固体Si3N4不再受H2O和O2的侵蚀?
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:

(1) 将菱锌矿研磨成粉的目的是_____。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Go![]() ethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
ethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液![]() 2”的pH时,理论上可选用的最大区间为______。
2”的pH时,理论上可选用的最大区间为______。
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
Ksp | 5.6× | — | 6.8× | 2.8× |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com