
题目列表(包括答案和解析)
弱电解质是指在水溶液里
________电离成离子的________,主要包括________、________、________和________.[注意]电解质的强弱与其溶解度的大小________,如________是强电解质.
弱电解质的电离程度可以用电离度表示,电离度指已电离的电解质分子数占溶液中原有电解质分子数的百分比.现有HX,HY,HZ三种一元酸,在25℃时它们水溶液的浓度和电离度如表3,则三种酸由强到弱的顺序是
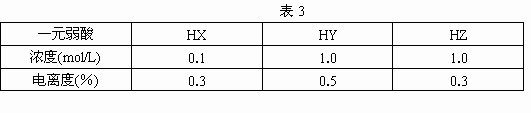
[ ]
电解质的电离
酸、碱、盐是电解质
(1)电解质和非电解质
电解质是指溶于________能够导电的化合物;非电解质是指________的化合物.Zn、Fe等金属在熔融状态虽能导电,但它们不是化合物,因而不是________,也不是________.
活泼金属的氧化物,如Na2O、Al2O3等,在熔融状态下能够导电,是由于它们自身电离出离子的缘故,因而是电解质:
Na2O(熔)![]()
Al2O3(熔)![]()
(2)强电解质和弱电解质
强电解质是指在水溶液里全部电离成离子的电解质;弱电解质是指在水溶液里只有一部分分子电离成离子的电解质.理解这两个概念,应注意以下几点:
①强、弱电解质的划分标准是在水溶液中电解质的电离程度.________的是强电解质,________的是弱电解质.
②强、弱电解质的概念,不能适用于所有电解质,如Na2O等与水反应的离子化合物,被认定是强电解质.
③强、弱电解质与物质的溶解性不是完全相关的.如CaCO3等虽几乎不溶于水,却是强电解质;CH3COOH虽可与水以任意比混溶,却是弱电解质;C2H5OH虽可与水以任意比混溶,却是非电解质.
④强、弱电解质与溶液的导电性强弱也不是完全相关的.溶液的导电性强弱主要是由溶液中________决定的,强电解质稀溶液中离子的浓度不一定比弱电解质浓溶液中的离子浓度大,因而导电性不一定强.
⑤强、弱电解质溶液中,溶质的存在形式不同.强电解质溶液中溶质的存在形式是________,弱电解质溶液中除阴、阳离子外,还大量存在溶质的________.
(3)电解质与细胞活动K+、Na+、Cl-对维持细胞内外体液中的水和电解质平衡发挥着重要作用.
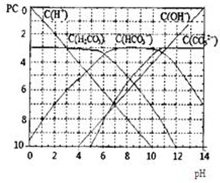 pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:(11分)pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题: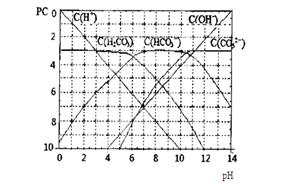
(1)在人体血液中,HCO3-能起到稳定人体PH的作用,请用电解质溶液中的平衡解释:
(用方程式表示)。
(2)H2CO3一级电离平衡常数的数值Ka1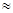
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确 。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1。c(CO32-)=0.075 mol·L-1,若t1时刻在上述体系中加入100 mL0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
(5)请画出t1时刻后Li+和CO32-浓度随时间变化关系图(用虚线表示Li+ ,实线表示CO32-)。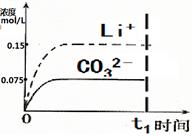
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com