
题目列表(包括答案和解析)

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | 环己醇 | 0.96 | 25 | 161 | 能溶于水 | 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
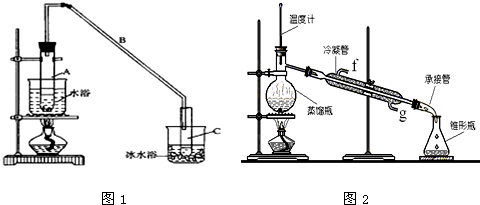
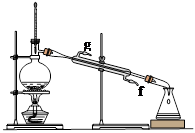
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: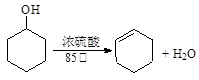 ;
;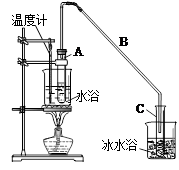
反应物和生成物的物理性质如下表:
| | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:

(1)该过程中产生的的CO可继续与水蒸气发生可逆反应得到CO2和H2,此反应的平衡常数表达式K =____________。
(2)CH3OH(l)气化时吸收的热量为27 kJ/mol,CH3OH(g)的燃烧热为677 kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式_________________。
(3) “催化还原”反应制乙二醇原理如下:
CH3OOC-COOCH3(g)+4H2(g)
 HOCH2-CH2OH(g)+2CH3OH(g)
△H = -34 kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g)
△H = -34 kJ/mol
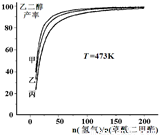
为探究实际生产的最佳条件,某科研小组进行了多方面研究。下图表示乙二醇达到平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5 MPa、2.5 MPa、3.5 MPa的情况,则曲线甲对应的压强是P(甲)=___________。

(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
① 草酸氢钾溶液中存在如下平衡:
H2O H++OH-、HC2O4-
H++OH-、HC2O4- H++C2O42-和
。
H++C2O42-和
。
② 向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是 (填序号)。
a.c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-)
b.c(K+) + c(Na+) = c(HC2O4-) + c(C2O42-)
c.c(Na+) = c(H2C2O4) + c(C2O42-)
d.c(K+) > c(Na+)
(5)以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为 ;若以甲烷代替该燃料电池中的甲醇,向外界提供相等电量,则每代替32 g甲醇,所需标准状况下的甲烷的体积为 L。
(16分)运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)已知:①4NH3(g)+3O2(g)===2N2(g)+6H2O(g)  H=-1266.8kJ·mol-1
H=-1266.8kJ·mol-1
②N2(g)+O2(g)===2NO(g)  H=180.5kJ·mol-1
H=180.5kJ·mol-1
写出氨高温催化氧化的热化学方程式 。
(2)氨气、空气可以构成燃料电池,其电池反应原理为4NH3+3O2===2N2+6H2O。则原电解质溶液显 (填“酸性”、“中性”或“碱性”),负极的电极反应式为 。
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
①由上表数据可知该反应为放热反应,理由是 ;
②理论上,为了增大平衡时H2的转化率,可采取的措施是 (填字母序号);
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400oC时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2mol·L-1、1mol·L-1时,此时刻该反应的v正(N2) v逆(N2)(填“>”、“<”或“=”)。
(4)①25oC时,将amol·L-1的氨水与0.1mol·L-1的盐酸等体积混合。当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= ;
②向25mL0.10mol·L-1的盐酸中滴加氨水至过量,该过程中离子浓度大小关系一定不正确的是 (填字母序号)。
a.c(Cl-)>c(H+)>c(NH4+)>c(OH-) b.c(C1-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com