
题目列表(包括答案和解析)
(9分)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)完成以下实验设计表(表中不要留空格)。
|
实验 编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解反应速率的影响 |
|
|
|
|
|
③ |
|
298 |
10 |
6.0 |
0.30 |
[数据处理]实验测得p—CP的浓度随时间变化的关系如图,①②③分别代表以上三组实验测得的数据曲线。
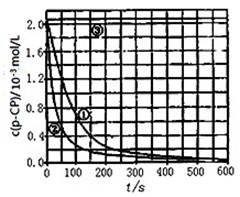
(2)请根据实验①曲线,计算降解反应在50~150s内的平均反应速率;v(p—CP)= mol·L-1·s-1。
(3)实验①、②表明温度升高,该降解反应速率_____。 (增大或减小)但其他文献表明,温度过高时(如接近100℃)反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: _________________________。
(4)实验③得出的结论是:pH等于10时, __
(5)实验时需在不同时间从反应器中取样,并使所取样品中反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)今有如下两个热化学方程式:?则a________b(填>,=,<)
H2(g)+![]() O2(g)=H2O(g) ΔH1=a kJ·mol-1
O2(g)=H2O(g) ΔH1=a kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH2=b kJ·mol-1
O2(g)=H2O(l) ΔH2=b kJ·mol-1
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.

已知反应N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1.试根据表中所列键能数据估算a的值:________.
2NH3(g) ΔH=a kJ·mol-1.试根据表中所列键能数据估算a的值:________.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.
已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s)和H2(g)生成1 mol C2H2(g)反应的反应热ΔH=________.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)实验测得,5 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,则甲醇的燃烧热ΔH=________.
(2)今有如下两个热化学方程式:?则a________b(填>,=,<)
H2(g)+(3)由气态基态原子形成1 mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
![]()
已知反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=a kJ·mol-1.试根据表中所列键能数据估算a的值:________(写出+或-).
2NH3(g) ΔH=a kJ·mol-1.试根据表中所列键能数据估算a的值:________(写出+或-).
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.
已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
根据盖斯定律,计算298 K时由C(s)和H2(g)生成1 mol C2H2(g)反应的反应热ΔH=________.
| 实验编号 | 实验目的 | T/K | pH | c/10-3mol.L-1 | |
| H2O | Fe2- | ||||
| (1) | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| (2) | 探究温度对降解反应速的影响率 | ||||
| (3) | 298 | 10 | 6.0 | 0.30 | |

(12分)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)。设计如下对比实验。
(1)请完成以下实验设计表(请填满表中空缺地方,表中不要留空格)。
|
实验编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验做参照 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解反应速率的影响 |
|
|
|
|
|
③ |
|
298 |
10 |
6.0 |
0.30 |
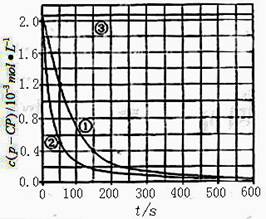
【数据处理】实验测得p-CP的浓度随时间变化的关系如右上图。
(2)请根据右上图实验①曲线,计算降解反应在50 -150内的反应速率ν(p-CP )=
【解释与结论】
(3)实验①②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所使用试剂H2O2的角度分析原因: ;
(4)实验③得出的结论是:pH=10时, ;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来,根据上图中信息,给出一种迅速停止反应的方法: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com