
题目列表(包括答案和解析)
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
叙述I 叙述II
A 水玻璃具有黏性 盛装烧碱溶液的试剂瓶不能用玻璃塞
B 往氯化钙溶液中通入足量的CO2
先有白色沉淀生成,后沉淀溶解 CaCO3不溶于水,Ca(HCO3)2可溶于水
C NH4Cl受热易分解 可用加热法除去I2中的NH4Cl
D 利用丁达尔现象区分氢氧化铁胶体和浓的氯化铁溶液 往氢氧化钠溶液中滴加饱和氯化铁溶液,加热至红褐色制得胶体
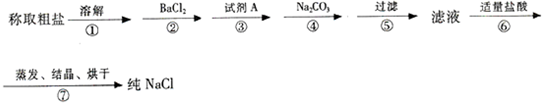
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),p(CO32-)=-lgc(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),p(CO32-)=-lgc(CO32-).下列说法正确的是( )| A、MgCO3、CaCO3、MnCO3的Ksp依次增大 | B、a点可表示MnCO3的饱和溶液,且c(Mn2+)>c(CO32-) | C、b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) | D、c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-) |
 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
| ||
| ① |
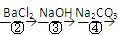
| ||
| ⑤ |
| ||
| ⑥ |
| ||
| ⑦ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com