
题目列表(包括答案和解析)
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
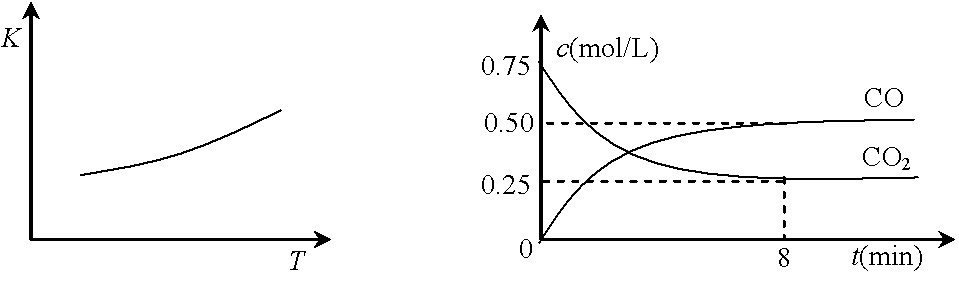
图甲 图乙
⑴该反应的平衡常数表达式K= ▲ 。
⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。
8分钟内,CO的平均反应速率v(CO)= ▲ mol/(L·min)。
⑶下列措施中能使平衡时c(CO)/c(CO2)增大的是 ▲ (填序号)。
A.升高温度 B.增大压强
C.充入一定量CO D.再加入一些铁粉
⑷铁的重要化合物高铁酸钠是一种新型饮用水消毒剂,具有氧化能力强、安全性好等优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O![]() Na2FeO4+3H2↑,则电解时阳极的电极反应式是 ▲ 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 ▲ 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化纳和水,该反应的离子方程式为 ▲ 。
(12分)理论上,SO2能发生类似CO2与澄清石灰水作用的反应,但在通常实验中,将SO2通入澄清石灰水却没有看到类似CO2那样先浑浊后澄清的现象。针对这一问题,研究性学习小组开展了探究性实验。

I.用图A所示的装置来分别做CO2、SO2与澄清石灰水的反应实验,结果通人CO2可看到先浑浊后澄清的现象,但通入SO2没看到浑浊现象。
Ⅱ.用图B的装置,将气体收集在注射器里,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,无论CO2还是SO2都能看到“先变浑再澄清”的现象。当以相同速率分别通人CO2或SO2,通入SO2产生现象明显比通入CO2产生现象快。
回答下列问题:
(1)通过上述I、Ⅱ实验,可以确定,将足量SO2缓慢通人澄清石灰水,依次发生的反应有:(用离子方程式表示) ; 。
(2)实验I中,通人SO2不能出现浑浊的原因可能是: 。
(3)实验Ⅱ中,同速率分别通入CO2或SO2,SO2产生现象比CO2快的相关因素有 。
①SO2在水中溶解度比CO2大。
②相同状态下,SO2的密度比CO2的密度大。
③亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,l mol亚硫酸电离产生的H+离子浓度大于l mol碳酸电离产生的H+离子浓度。
④SO2有毒和刺激性气味, CO2无毒和无刺激性气味。
⑤相同条件下,1 mol SO2与足量石灰水反应生成CaSO3的速率大于1 mol CO2与足量石灰水反应生成CaCO3的速率。
⑥相同条件下,1 molCaSO3被1mol SO2(形成的H+离子)溶解形成可溶性Ca(HSO3)2
的速率大于1molCaCO3被1molCO2(形成的H+离子)溶解形成可溶性Ca(HCO3)2的速率。
理论上,SO2能发生类似CO2与澄清石灰水作用的反应,但在通常实验中,将SO2通入澄清石灰水却没有看到类似CO2那样先浑浊后澄清的现象。针对这一问题,研究性学习小组开展了探究性实验。
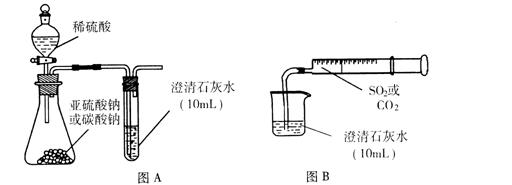
I.用图A所示的装置来分别做CO2、SO2与澄清石灰水的反应实验,结果通人CO2可看到先浑浊后澄清的现象,但通入SO2没看到浑浊现象。
Ⅱ.用图B的装置,将气体收集在注射器里,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,无论CO2还是SO2都能看到“先变浑再澄清”的现象。当以相同速率分别通人CO2或SO2,通入SO2产生现象明显比通入CO2产生现象快。
回答下列问题:
(1)通过上述I、Ⅱ实验,可以确定,将足量SO2缓慢通人澄清石灰水,依次发生的反应有:(用离子方程式表示) ; 。
(2)实验I中,通人SO2不能出现浑浊的原因可能是: 。
(3)实验Ⅱ中,同速率分别通入CO2或SO2,SO2产生现象比CO2快的相关因素有 。
①SO2在水中溶解度比CO2大。
②相同状态下,SO2的密度比CO2的密度大。
③亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,l mol亚硫酸电离产生的H+离子浓度大于l mol碳酸电离产生的H+离子浓度。
④SO2有毒和刺激性气味,CO2无毒和无刺激性气味。
⑤相同条件下,1 mol SO2与足量石灰水反应生成CaSO3的速率大于1 mol CO2与足量石灰水反应生成CaCO3的速率。
⑥相同条件下,1 molCaSO3被1mol SO2(形成的H+离子)溶解形成可溶性Ca(HSO3)2
的速率大于1molCaCO3被1molCO2(形成的H+离子)溶解形成可溶性Ca(HCO3)2的速率。
(12分)理论上,SO2能发生类似CO2与澄清石灰水作用的反应,但在通常实验中,将SO2通入澄清石灰水却没有看到类似CO2那样先浑浊后澄清的现象。针对这一问题,研究性学习小组开展了探究性实验。
I.用图A所示的装置来分别做CO2、SO2与澄清石灰水的反应实验,结果通人CO2可看到先浑浊后澄清的现象,但通入SO2没看到浑浊现象。
Ⅱ.用图B的装置,将气体收集在注射器里,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,无论CO2还是SO2都能看到“先变浑再澄清”的现象。当以相同速率分别通人CO2或SO2,通入SO2产生现象明显比通入CO2产生现象快。
回答下列问题:
(1)通过上述I、Ⅱ实验,可以确定,将足量SO2缓慢通人澄清石灰水,依次发生的反应有:(用离子方程式表示) ; 。
(2)实验I中,通人SO2不能出现浑浊的原因可能是: 。
(3)实验Ⅱ中,同速率分别通入CO2或SO2,SO2产生现象比CO2快的相关因素有 。
①SO2在水中溶解度比CO2大。
②相同状态下,SO2的密度比CO2的密度大。
③亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,l mol亚硫酸电离产生的H+离子浓度大于l mol碳酸电离产生的H+离子浓度。
④SO2有毒和刺激性气味, CO2无毒和无刺激性气味。
⑤相同条件下,1 mol SO2与足量石灰水反应生成CaSO3的速率大于1 mol CO2与足量石灰水反应生成CaCO3的速率。
⑥相同条件下,1 molCaSO3被1mol SO2(形成的H+离子)溶解形成可溶性Ca(HSO3)2
的速率大于1molCaCO3被1molCO2(形成的H+离子)溶解形成可溶性Ca(HCO3)2的速率。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com