
题目列表(包括答案和解析)
图中X、Y、Z、 W是地壳含量前四位(不按顺序)的元素组成的单质,其它为化合物,A有磁性。它们之间存在如下转化关系(部分产物已略去)。
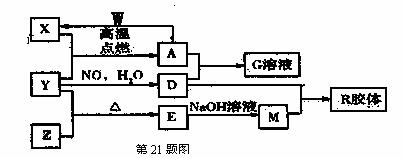
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是 , M的化学式是 ;
(2)胶体的应用非常广泛,早在150年前的1862年,英国科学家格雷阿姆就提出了"胶体"的概念,R胶体中分散质直径大小范围为: ,可利用 区分胶体和溶液;
(3)写出A与 W反应的化学方程式: ;
(4)写出A和足量D的稀溶液反应生成G的离子方程式:
(5)简述检验G溶液中的金属阳离子的实验方法(操作、现象、结论)
(6)工业由E制备Z的反应方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com