
题目列表(包括答案和解析)
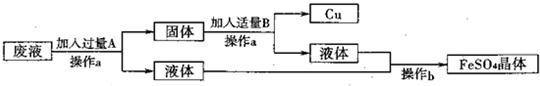
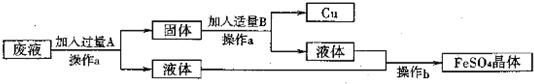


| 操作步骤 | 目的 |
| ①将废水过滤 | ① 除去不溶性杂质 |
| ②向滤液中加入过量铁粉 | ② 与硫酸铜完全反应 |
| ③ 过滤 |
③将Cu和过量的铁粉与FeSO4溶液分离 |
| ④在过滤后固体混合物中加入过得量稀硫酸 | ④ 除去过量的铁 |
| ⑤将反应后的混合物过滤 | ⑤ 得到硫酸亚铁溶液和铜 |
| ⑥ 将滤液蒸发结晶 |
⑥得到硫酸亚铁晶体 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com