
题目列表(包括答案和解析)
| A、水电离过程的热化学方程式可表示为:H2O(l)?H+(aq)+OH-(aq)△H=(a-b)KJ/mol | B、当滴入10mL盐酸时,溶液中:c(NH4+)+c(NH3?H2O)=2c(Cl-) | C、随着盐酸的逐滴加入,水电离的c(OH-)总是逐渐减小 | D、当滴入20 mL盐酸时,溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
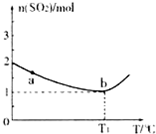 研究化学反应原理对于生产、生活及环境保护具有重要意义.
研究化学反应原理对于生产、生活及环境保护具有重要意义.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com