
题目列表(包括答案和解析)
氨气是一种重要工作原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)="2NO(g) " △ H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=_________________________。
(2)工业合成氨气的反应为N2(g)+3H2(g)  2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
①增大压强 ②增大反应物的浓度 ③使用催化荆 ④降低温度
( 3 )①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 ? 。实验室还可在 ? (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
②常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序
为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)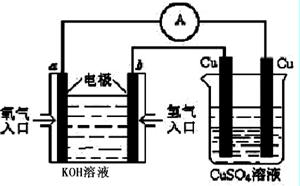
①氢氧燃料电池具有广阔的发展前景。如下图所示:
右边Cu电极反应式是 。
a电极的电极反应式
②工业上生产氢气是将水蒸气通过红热的炭,产生水煤气:
C(s) + H2O(g)  H2(g) + CO(g) △H =" +131.3" kJ/mol
H2(g) + CO(g) △H =" +131.3" kJ/mol
该反应在低温下不能自发进行的原因是 。
| A.△H >0 | B.温度较低时,△H影响为主 |
| C.△S<0 | D.温度较低时,△S影响为主 |
氨气是一种重要工作原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △ H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=_________________________。
(2)工业合成氨气的反应为N2(g)+3H2(g) ![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_________ _________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_________ _________。
①增大压强 ②增大反应物的浓度 ③使用催化荆 ④降低温度
( 3 )①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 。实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
② 常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③ 将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序
为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)

①氢氧燃料电池具有广阔的发展前景。如下图所示:
右边Cu电极反应式是 。
a电极的电极反应式
②工业上生产氢气是将水蒸气通过红热的炭,产生水煤气:
C(s) + H2O(g) ![]() H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol
该反应在低温下不能自发进行的原因是 。
A.△H >0 B.温度较低时,△H影响为主
C.△ S<0 D.温度较低时,△S影响为主
氨气是一种重要工作原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △ H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=_________________________。
(2)工业合成氨气的反应为N2(g)+3H2(g) ![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_________ _________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_________ _________。
①增大压强 ②增大反应物的浓度 ③使用催化荆 ④降低温度
( 3 )①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 ?? 。实验室还可在 ?? (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
② 常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③ 将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序
为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)

①氢氧燃料电池具有广阔的发展前景。如下图所示:
右边Cu电极反应式是 。
a电极的电极反应式
②工业上生产氢气是将水蒸气通过红热的炭,产生水煤气:
C(s) + H2O(g) ![]() H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol
该反应在低温下不能自发进行的原因是 。
A.△H >0 B.温度较低时,△H影响为主
C.△ S<0 D.温度较低时,△S影响为主
(18分)碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号F火箭的燃料是液态偏二甲肼(CH3-NH-NH-CH3),氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式________________________________________。
(2)298 K时,在2L的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。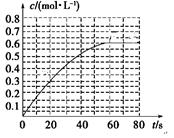
①298k时,该反应的平衡常数为________ L ·mol-1。
②下列事实能判断该反应处于平衡状态的是
a.混合气体的密度保持不变
b.混合气体的颜色不再变化
c. V(N2O4)正=2V(NO2)逆
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时
V(正) V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。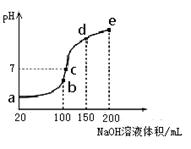
试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是__________;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常
数K数值的是 ;
③在c点,溶液中各离子浓度由大到小的排列顺序
是__________。
二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景。
(1)已知H2、CO和CH3OCH3的燃烧热(ΔH)分别为-285.5kJ/mol、-283kJ/mol和-1460.0 kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为 。
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如下图所示:
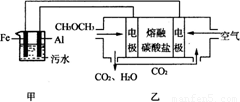
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式 ;下列物质可用做电池熔融碳酸盐的是 。
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式: 。
③已知常温下Kap[Fe(OH)3]=4.0×10—38,电解一段时间后,甲装置中c(Fe3+)= 。
④已知:H2S的电离平衡常数:K1=9.1×10—8、K2=1.1×10—12;H2CO3的电离平衡常数:K1=4.31×10—7、K2=5.61×10—11。测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列各项正确的是
A.发生反应的离子方程式为:CO2+S2—+H2O=CO32—+H2S
B.发生反应的离子方程式为:CO2+S2—+H2O=HCO3—+HS—
C.c(Na+)=2[c(H2S)+c(HS—)+c(S2—)]
D.c(Na+)+c(H+)=2c(CO32—)+2c(S2—)+c(OH—)
E.c(Na+)>c(HCO3—)>c(HS—)>c(OH—)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com