
题目列表(包括答案和解析)
在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管。下列对其作用的叙述中正确的是( )
| A.防止氯气造成大气污染 |
| B.使反应的氯气循环使用 |
| C.使烧瓶内的压强与大气压保持一致 |
| D.使分液漏斗中的液体更容易注入烧瓶 |
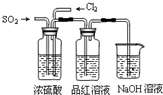
某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如图所示装置: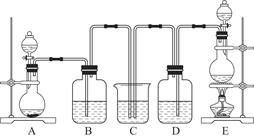
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的特质有________________。
(2)反应开始后,发现B、D两个集气瓶中的品红溶液都褪色,停止通气后,用热水浴给B、D两个集气瓶加热。两个集气瓶中的现象分别为:B____________________;D____________________。
(3)装置C的作用是______________________________________________________。
(4)该实验小组的甲、乙两位同学利用上述两个发生装置按图所示装置继续进行实验: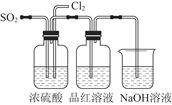
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题:
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸中的目的:________________________________________________________________________________________________________________________________________________。
②试分析甲同学实验过程中,品红溶液不褪色的原因是____________________________________________________________________________________________________________________________________________________________________________________________________________________。(结合离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?
________________________________________________________________________。
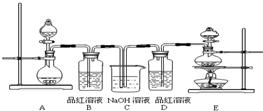
三氯化铁是中学化学实验室中必不可少的重要试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,充分反应后溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3挥发,再降温结晶得FeCl3·6H2O晶体.填写下列空白:

(1)滴加盐酸,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是________;
(2)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O晶体,而不用直接蒸干溶液的方法来制得晶体的理由________;
(3)用该法制得的晶体中往往混有Fe(NO3)3,为了制得较纯净的FeCl3·6H2O,可将烧杯内的稀硝酸换成________;
(4)若要求废铁屑的纯度,需要测出从B中排出气体的体积.若测得排出的气体体积为V(已折算成标准状况,单位:L),则废铁屑的纯度为________(用m、V的代数式表示);
(5)为了测出从B中放出气体的体积V,请自选仪器在C处设计简便、合理的集气装置,并在上面框格中画出该装置图(假设所用仪器的体积均足够大).

填写下列空白:
(1)如何检查装置A的气密性:________________________。
(2)滴加盐酸时,发现反应速率较之同浓度盐酸与纯铁粉反应要快,其原因是_____________
___________________。
(3)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是_______________________________________________________。
(4)用该法制得的晶体中往往混有Fe (NO3)3,为了制得较纯净的FeCl3·6H2O,可将烧杯内的稀硝酸换成________________________________________。
(5)若要测废铁屑的纯度,可测出从B中放出气体的体积V (已折算成标准状况,单位:L),则废铁屑的纯度为__________(用含m、V的代数式表示),请在框图C中画出必要的装置。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com