
题目列表(包括答案和解析)
[江苏省南通中学2008学年度第一学期期末复习高三化学 ].某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙、丙三套装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分。仪器中盛放的试剂为:a-无水乙醇(沸点:78 ℃);b-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。
(1)简述两套方案各自的优点:甲:_________________、_________________________,
乙:___________________
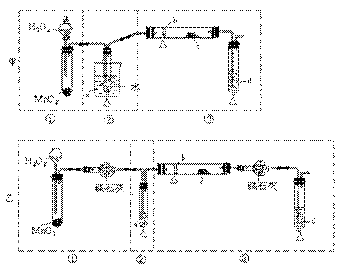 (2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为________________(例如甲①,乙②)
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为________________(例如甲①,乙②)
(3)若要保证此实验有较高的效率,还需补充的仪器有__________。理由______。
(4)实验中能验证乙醇氧化产物的实验现象是_______________。
(5)装置中,若撤去第①部分,其它操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com