
题目列表(包括答案和解析)
(10分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示S形成硫酸酸雨的反应方程式 , 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣),n(HSO3﹣)变化关系如下表:
|
n(SO3²﹣):,n(HSO3﹣) |
91:9 |
1:1 |
1:91 |
|
PH |
8.2 |
7.2 |
6.2 |
①上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):


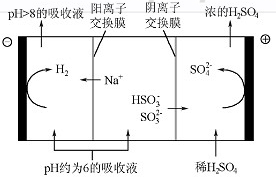
(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:

①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用。简述再生原理:
。
(10分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示S形成硫酸酸雨的反应方程式 , 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣),n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):,n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
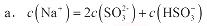
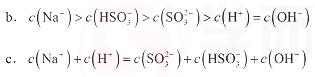
直接排放含S![]() ,的烟气会形成胶雨,危害环境。利用钠碱循环法可脱除烟气中的S
,的烟气会形成胶雨,危害环境。利用钠碱循环法可脱除烟气中的S![]() ,.
,.
(1) 用化学方程式表示S![]() :形成硫酸型胶雨的反应:
:形成硫酸型胶雨的反应:
(2) 在钠碱循环法中,Na ₂SO ₃,溶液作为吸收液,可由NaOH溶液吸收SO ₂:制得,该反应的离子方程式是
(3) 吸收液吸收SO ₂的过程中,pH随n(SO₃ ²﹣):,n(HSO ₃﹣)变化关系如下表:
| n(SO₃ ²﹣):,n(HSO ₃﹣) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
①上表判断Na ₂SO ₃溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
![]()

(4) 当吸收液的pH降至约为6时,满送至电解槽再生。再生示意图如下:
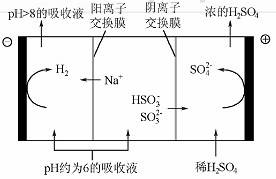
①HSO3在阳极放电的电极反应式是 。
②当阴极室中溶液PH升至8以上时,吸收液再生并掀环利用。简述再生原理:
(13分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO?²﹣):n(HSO?﹣) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(13分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO₃²﹣):n(HSO₃﹣) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
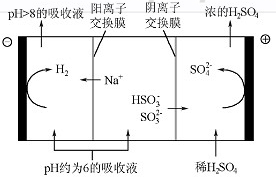
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com