
题目列表(包括答案和解析)
(5分)(1)化学反应2A(g)+B(?)  2C(g)达到化学平衡时:
2C(g)达到化学平衡时:
①升高温度时,C的量减少,则反应物的能量总和____________生成物的能量总和(填“>”、“<”或“=”)。
②如果增大压强,平衡向正反应方向移动,则B是____________态物质。
③若增加B的物质的量,平衡不移动,说明B是____________态物质。
(2)如图,在恒压密闭容器中加入2 mol A和2 mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:2 A(g)+B(g)  x C(g)平衡时A、B、C的物质的量之比为1
x C(g)平衡时A、B、C的物质的量之比为1 ∶3∶4,C的物质的量为 y mo
∶3∶4,C的物质的量为 y mo l。
l。
根据题中数据计算,x =_________、y =_________;
(5分)(1)化学反应2A(g)+B(?)
 2C(g)达到化学平衡时:
2C(g)达到化学平衡时:
①升高温度时,C的量减少,则反应物的能量总和____________生成物的能量总和(填“>”、“<”或“=”)。
②如果增大压强,平衡向正反应方向移动,则B是____________态物质。
③若增加B的物质的量,平衡不移动,说明B是____________态物质。
(2)如图,在恒压密闭容器中加入2 mol A和2 mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:2 A(g)+B(g)
 x C(g)平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。
x C(g)平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。
根据题中数据计算,x =_________、y =_________;
(12分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O2(g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) = 2CO(g) △H2=+172.5 kJ·mol—1 ②
4CO(g)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
请回答下列问题:
⑴计算3Fe(s)+2O2(g) = Fe3O4(s)的△H=___________________。
⑵800℃时,C(s)+CO2(g)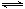 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
⑶某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①计算该铁矿石中铁元素的质量分数。(请写出必要的解题步骤)
②计算氧化物FemOn的化学式(m、n为正整数)(请写出必要的解题步骤)
(5分)(1)化学反应2A(g)+B(?)2C(g)达到化学平衡时:
①升高温度时,C的量减少,则反应物的能量总和____________生成物的能量总和(填“>”、“<”或“=”)。
②如果增大压强,平衡向正反应方向移动,则B是____________态物质。
③若增加B的物质的量,平衡不移动,说明B是____________态物质。
(2)如图,在恒压密闭容器中加入2 mol A和2 mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:2 A(g)+B(g)x C(g)平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。
根据题中数据计算,x =_________、y =_________;
(12分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O2(g)= CO2(g) △H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) =2CO(g) △H2=+172.5 kJ·mol—1 ②
4CO(g)+Fe3O4(s)= 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
请回答下列问题:
⑴计算3Fe(s)+2O2(g) = Fe3O4(s)的△H=___________________。
⑵800℃时,C(s)+CO2(g)2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
⑶某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①计算该铁矿石中铁元素的质量分数。(请写出必要的解题步骤)
②计算氧化物FemOn的化学式(m、n为正整数)(请写出必要的解题步骤)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com