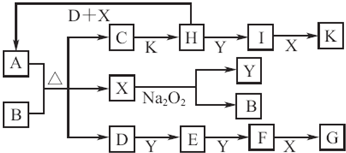
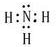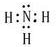短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.
请回答下列问题:
(1)C的最高价氧化物对应水化物电子式为______,其中含有的化学键类型为______.
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为______
(3)用石墨电极电解CD的饱和溶液,若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体的物质的量为______mol.
(4)E元素与D元素可形成ED
2和ED
3两种化合物,下列说法正确的是(填序号)______.
①保存ED
2溶液时,需向溶液中加入少量E单质
②ED
2只能通过置换反应生成,ED
3只能通过化合反应生成
③铜片、碳棒和ED
3溶液组成原电池,电子由铜片沿导线流向碳棒④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED
3的浓溶液,原无色溶液都变成紫色
(5)25℃时,将pH=4.00的A元素与D元素形成化合物AD的水溶液稀释1.00×10
3倍,则稀释后溶液中各离子浓度必遵循的定量等式关系式是______.
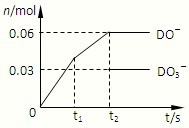
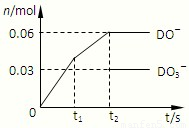
(6)将一定量的D单质通入一定浓度的苛性钾溶液,两者恰好完全反应(已知反应过程放热),生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是______.

 A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表.Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子.
A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表.Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子.