
题目列表(包括答案和解析)
对于可逆反应,达到平衡时,各生成物浓度以其计量数为指数幂的乘积与各反应物浓度以其计量数为指数幂的乘积之比为一常数,它只与温度有关,该常数叫做化学平衡常数,用K表示。
![]() 例如:对于aA+Bb mC+nD
例如:对于aA+Bb mC+nD
![]() K=―――――――― (其中[ ]表示物质的量浓度,固体的浓度为1。)
K=―――――――― (其中[ ]表示物质的量浓度,固体的浓度为1。)
反应Fe(固)+CO2(气)![]() FeO(固)+CO(气)的平衡常数为K1;反应
FeO(固)+CO(气)的平衡常数为K1;反应
Fe(固)+H2O(气)![]() FeO(固)+H2(气)的平衡常数为K2。在不同温度时K1、K2的值如下表:
FeO(固)+H2(气)的平衡常数为K2。在不同温度时K1、K2的值如下表:
| 温度(绝对温度) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)推导反应CO2(气)+H2(气)![]() CO(气)+H2O(气)的平衡常数K与K1、K2的关系式: 。
CO(气)+H2O(气)的平衡常数K与K1、K2的关系式: 。
(2)计算K值:温度为973开时K= ;1173开时:K= 。通过K值的计算(1)反应是 反应(填“吸热”或“放热”)。
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2O(气),在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
| 时间/min | CO2 | H2O | CO | H2 |
| 0 | 0.2000 | 0.3000 | 0 | 0 |
| 2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | |
| 5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
| 6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率是: 。
②在3~4min之间,反应处于 状态(填“平衡”或“非平衡”)。
③第6min时,平衡向 方向移动,可能的原因是 。
(14分)曾经有一种固氮的方法:1100°C通N2和CaC2反应得到CaCN2 。
已知:CaCN2+3H2O = 2NH3+CaCO3;CaC2+2H2O = C2H2↑+Ca(OH)2
(1)某同学采用以下装置(加热和夹持仪器已略去)制取少量的CaCN2
①U形管中盛放的物质是 (填一种);
② (填“能”或“不能”)用普通玻璃管代替图中石英管;
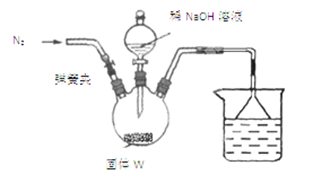
(2)检验反应后的固体(用W表示)中含有氮元素该同学将适量W溶于水,有气泡产生,说明固体中含有氮元素,该结论不正确。若要得出正确结论,还需进行的实验是 。
(3)测定W中CaCN2的质量分数
步骤Ⅰ:按如图所示装置(夹持仪器已略去)进行实验:关闭弹簧夹,将漏斗中溶液逐滴加入到三颈瓶中,当W反应完全后,打开弹簧夹,通入氮气,直至氨气被200mL0.1 mol·L-1硫酸完全吸收。
步骤Ⅱ:准确量取烧杯中溶液20.00mL置于锥形瓶中,滴入几滴指示剂,用cmol·L-1NaOH溶液滴定过量的硫酸,实验测得消耗标准溶液的平均体积为vmL。
已知三种常用指示剂变色pH范围如下:
| 指示剂 | a | b | c |
| 变色pH范围 | 3.1~4.4 | 8.0~10.0 | 4.4~6.2 |
| 说明 | pH<3.1显红色 pH>4.4显黄色 | pH<8.0显无色 pH>10.0显红色 | pH<4.4显红色 pH>6.2显黄色 |
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
|
温 度(℃) |
360 |
440 |
520 |
|
K值 |
0.036 |
0.010 |
0.0038 |
(1)①由上表数据可知该反应为放热反应,理由是 。
② 理论上,为了增大平衡时H2的转化率,可采取的措施是 。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)
+ H2O (g) CO(g)
+ 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)
+ 3H2(g) 获取,已知该反应中,当初始混合气中的 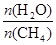 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
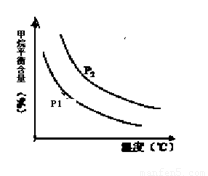
①图中,两条曲线表示压强的关系是:P1 P2(填“>”、“=”或“<”)。
②该反应为 反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) +
H2O(g) CO2
(g) + H2(g) 获取。
CO2
(g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2)=1 : 16 : 6 : 6
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
 CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的 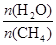 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: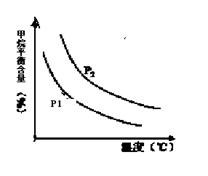
 CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。(15分)现有A、B、D、X、Y、Z六种元素,其原子序数依次递增。已知,B、D的氧化物都是汽车尾气的主要有害成分;A、Y是短周期非金属元素,其单质在常温下均为气体。两单质混合见光爆炸生成AY,AY溶液显强酸性。X、Z为常见金属元素,X的原子序数为Z的一半。Z与Y2和A Y溶液反应分别得ZY 3和ZY 2,烧碱溶液不能与Z单质反应,而能与X单质反应。请回答下列问题:
(1)Y的原子结构示意图为 ;X在周期表中的位置是 。
(2)D的氧化物也是空气质量预报的指标之一。汽车尾气中产生D的氧化物的化学反应方程式为 。
(3)写出X单质与NaOH溶液反应的离子方程式
。
(4)电浮选凝聚法是工业上采用的一种污水处理方法。右图是该方法处理污水的实验装置示意图(X、F金属单质作电极)。实验过程中,污水的pH始终保持在5.0~6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。阳极的电极反应有两个,分别是4OH--4e-=2H2O +O2↑和 。阳极区生成沉淀的离子方程式是 。
(5)一定条件下,8mol X与3molZ的氧化物W恰好反应,则W的化学式为 ;指出X单质与F的氧化物反应的一种用途 。
(6)BA4是一种重要能源物质,右图是1.01×105Pa下,1 mol BA4燃烧生成稳定化合物过程中的能量变化示意图,其热化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com