
题目列表(包括答案和解析)
化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中Na2CO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:________。
(2)实验中,需加热至恒重的目的是________。
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3—=BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为________。
(2)实验中判断沉淀是否完全的方法是________。
方案三:按如下图所示装置进行实验: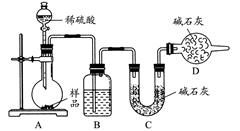
(1)D装置的作用是________。分液漏斗中________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90 g样品,实验后测得C装置增重8.80 g,则样品中Na2CO3的质量分数为________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷,该缺陷是________。

(14分)
某化学课外小组利用H2还原R2O3粉末测定R元素的相对原子质量,下图是测量装置的示意图(加热和夹持装置略去),A中的试剂是稀盐酸,B中固体是锌粒。
请回答下列问题:
(1)连接好装置后的实验操作依次是______________(填操作序号)
①检验氢气纯度 ②加热E ③检验装置气密性 ④点燃G管逸出的气体 ⑤从A瓶逐滴滴加液体
(2)C中的试剂是____________,其作用为_____________。
(3)从G管逸出的气体需要燃烧除去的原因是______________。
(4)在稀盐酸中加入少量CuSO4溶液,发现B中产生气体的速度明显加快,你认为原因是______________。
(5)该化学课外小组从实验中测得了下列数据:
①空E管的质量a;②E管和R 2O 3的总质量b;③充分反应后E管和R粉的总质量c(冷却到温室称量);④反应前F管及内盛物的总质量d;⑤充分反应后F管及内盛物的总质量e ;
根据以上数据列出二个计算R的相对原子质量的不同计算式(除R外,其它涉及的元素的相对原子质量均为已知):
计算式1:Ar(R)=__________________;
计算式2:Ar(R)=__________________。
(14分)
某化学课外小组利用H2还原R2O3粉末测定R元素的相对原子质量,下图是测量装置的示意图(加热和夹持装置略去),A中的试剂是稀盐酸,B中固体是锌粒。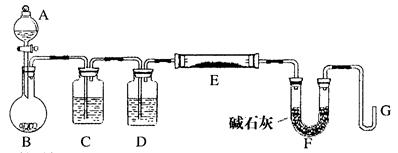
请回答下列问题:
(1)连接好装置后的实验操作依次是______________(填操作序号)
①检验氢气纯度 ②加热E ③检验装置气密性 ④点燃G管逸出的气体 ⑤从A瓶逐滴滴加液体
(2)C中的试剂是____________,其作用为_____________。
(3)从G管逸出的气体需要燃烧除去的原因是______________。
(4)在稀盐酸中加入少量CuSO4溶液,发现B中产生气体的速度明显加快,你认为原因是______________。
(5)该化学课外小组从实验中测得了下列数据:
①空E管的质量a;②E管和R 2O 3的总质量b;③充分反应后E管和R粉的总质量c(冷却到温室称量);④反应前F管及内盛物的总质量d;⑤充分反应后F管及内盛物的总质量e ;
根据以上数据列出二个计算R的相对原子质量的不同计算式(除R外,其它涉及的元素的相对原子质量均为已知):
计算式1:Ar(R)=__________________;
计算式2:Ar(R)=__________________。
(12分)某化学小组探究液体有机物样品A(C3 H8 O2)的结构,进行如下实验。实验I:用右图实验装置,通过Na与A反应确定羟基个数。
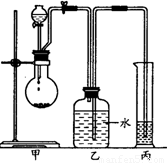
试回答下列问题:
(1)有机物A从 (填仪器名称)中加入;检验装置甲的气密性的方法是 。
(2)实验前预先将小块钠在二甲苯中熔化成若干个小球并冷却后再与有机物A反应,其目的是 。
(3)实验数据记录如下:p=l.038 g·mL-1
|
实验编号 |
有机样品的体积 |
有机样品的质量 |
生成气体的体积(标准状况下) |
|
I |
3.65mL |
3.8g |
1120mL |
|
II |
7.30mL |
7.6g |
2240mL |
|
III |
14.60mL |
15.2g |
4000mL |
①不能选第 组数据来计算A中羟基个数,这组数据出现错误的原因可能是 ,
②有机物A中羟基个数为 。
实验Ⅱ:
欲确定有机物A中含氧官能团的位置,进行如下实验:
①取7.30 mL A,Cu作催化剂,经氧化后完全转化成液态有机物B。
②取一质量为m1g的洁净试管,向其中加入足量银氨溶液,滴人化合物B,并水浴加热,待充分反应后,静置,小心倒出上层清液,向试管中小心滴加蒸馏水,倒出,再加入蒸馏水,再倒出,最后将试管烘干并称量。重复2次,试管质量均为m2g。
试回答下列问题:
(1)步骤②中小心滴加蒸馏水的目的是 。
(2)若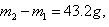 则有机物A的结构简式是
。
则有机物A的结构简式是
。
(3)试写出液态有机物B与银氨溶液反应的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com