
题目列表(包括答案和解析)
高氯酸按(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是________.
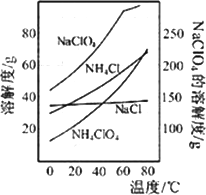
(2)反应得到的混合溶液中NH4ClO4和NaCI的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见下图).从混合溶液中获得较多NH4CIO4晶体的实验操作依次为________(填操作名称)干燥.

(3)样品中NH4CIO4的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装代已略去),实验步骤如下:

步骤1:按上图所示组装仪器,检查装置气密性.
步骤2:准确称取样品a g(约0.5 g)于蒸馏烧瓶中,加入约150 mL水溶解.
步骤3:准确量取40.00 mL约0.1 mol·L-1 H2SO4溶解于锥形瓶中.
步骤4:经滴液漏斗向蒸馏瓶中加入20 mL 3 mol·L-1 NaOH溶液.
步骤5:加热蒸馏至蒸馏烧瓶中神域约100 mL溶液.
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中.
步骤7:向锥形瓶中加入酸碱指示剂,用c mol·L-1 NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL
步骤8.将实验步骤1-7重复2次
①步骤3中,准确量取40.00 ml H2SO4溶液的玻璃仪器是________.
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是________(填写步骤号).
③为获得样品中NH4ClO4 的含量,还需补充的实验是________.
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取NaClO4(aq)+NH4Cl(aq)![]() NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是________.
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图).从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)________、干燥.
(3)样品中NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装置已略去),实验步骤如下:
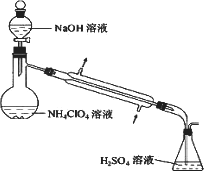
步骤1:按上图所示组装仪器,检查装置气密性.
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150 mL水溶解.
步骤3:准确量取40.00 mL约0.1 mol·L-1H2SO4 溶解于锥形瓶中.
步骤4:经滴液漏斗向蒸馏瓶中加入20 mL 3 mol·L-1 NaOH溶液.
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100 mL溶液.
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中.
步骤7:向锥形瓶中加入酸碱指示剂,用c mol·L-1NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1mL.
步骤8.将实验步骤1~7重复2次
①步骤3中,准确量取40.00 ml H2SO4 溶液的玻璃仪器是________.
②步骤1~7中确保生成的氨被稀硫酸完全吸收的实验是________(填写步骤号).
③为获得样品中NH4ClO4 的含量,还需补充的实验是________.
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
NH4ClO4 (aq)+NH4Cl(aq)![]() NH4ClO4 (aq)+NaCl(aq)
NH4ClO4 (aq)+NaCl(aq)
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供
热就能进行,其原因是 。
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图9)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)
、干燥。
(3)样品中NH4CIO4的含量可用蒸馏法进行测定,蒸馏装置如图10所示(加热和仪器固定装置已略去),实验步骤如下:
步骤1:按图10所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约![]() H2SO4 溶解于锥形瓶中。
H2SO4 溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入20mL NaOH 溶液。
NaOH 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用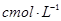 NaOH标准溶液滴定至终点,消耗NaOH标准溶液
NaOH标准溶液滴定至终点,消耗NaOH标准溶液
步骤8.将实验步骤1-7重复2次
①步骤3中,准确量取40.00ml H2SO4 溶液的玻璃仪器是________。
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是_____(填写步骤号)。
③为获得样品中NH4ClO4的含量,还需补充的实验是 _____
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
NH4ClO4 (aq)+NH4Cl(aq) NH4ClO4 (aq)+NaCl(aq)
NH4ClO4 (aq)+NaCl(aq)
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供
热就能进行,其原因是 。
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图9)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)
、干燥。
(3)样品中NH4CIO4的含量可用蒸馏法进行测定,蒸馏装置如图10所示(加热和仪器固定装置已略去),实验步骤如下: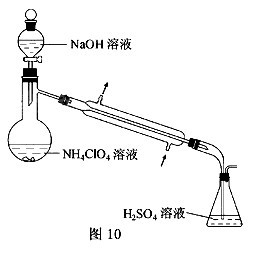
步骤1:按图10所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约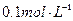 H2SO4 溶解于锥形瓶中。
H2SO4 溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入20m L
L NaOH 溶液。
NaOH 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用 NaOH标准溶液滴定至终点,消耗NaOH标准溶液
NaOH标准溶液滴定至终点,消耗NaOH标准溶液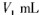
步骤8.将实验步骤1-7重复2次
①步骤3中,准确量取40.00ml H2SO4 溶液的玻璃仪器是________。
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是_____(填写步骤号)。
③为获得样品中NH4ClO4 的含量,还需补充的实验是 _____
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
NH4ClO4 (aq)+NH4Cl(aq) NH4ClO4 (aq)+NaCl(aq)
NH4ClO4 (aq)+NaCl(aq)
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供
热就能进行,其原因是 。
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图9)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)
、干燥。

(3)样品中NH4CIO4的含量可用蒸馏法进行测定,蒸馏装置如图10所示(加热和仪器固定装置已略去),实验步骤如下:
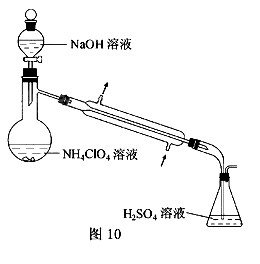
步骤1:按图10所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约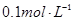 H2SO4 溶解于锥形瓶中。
H2SO4 溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入20mL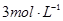 NaOH 溶液。
NaOH 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用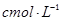 NaOH标准溶液滴定至终点,消耗NaOH标准溶液
NaOH标准溶液滴定至终点,消耗NaOH标准溶液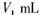
步骤8.将实验步骤1-7重复2次
①步骤3中,准确量取40.00ml H2SO4 溶液的玻璃仪器是________。
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是_____(填写步骤号)。
③为获得样品中NH4ClO4 的含量,还需补充的实验是 _____
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com