(2013?通州区二模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO
2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe
2O
3(s)+3C(石墨)=2Fe(s)+3CO(g)△H
1=+489.0kJ/mol
C(石墨)+CO
2(g)=2CO(g)△H
2=+172.5kJ/mol
则CO还原Fe
2O
3的热化学方程式为
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol
;
②氯化钯(PdCl
2)溶液常被应用于检测空气中微量CO.PdCl
2被还原成单质,反应的化学方程式为
PdCl2+CO+H2O=Pd+CO2+2HCl
PdCl2+CO+H2O=Pd+CO2+2HCl
;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C
3H
8和O
2构成丙烷燃料电池.
①负极电极反应式是:
C3H8-20e-+26OH-=3CO32-+17H2O
C3H8-20e-+26OH-=3CO32-+17H2O
;
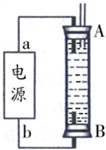
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)
2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是
ABD
ABD
(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H
++2e
-=H
2↑
(3)将不同量的CO(g)和H
2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H
2O(g)?CO
2(g)+H
2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
| H2O |
CO |
CO2 |
| 1 |
650 |
2 |
4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
3 |
| 3 |
900 |
1 |
2 |
0.4 |
1 |
①该反应的正反应为
放热
放热
(填“吸”或“放”)热反应;
②实验2中,平衡常数K=
;
③实验3跟实验2相比,改变的条件可能是
使用了催化剂;加大了压强
使用了催化剂;加大了压强
(答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
.

 (2013?通州区二模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(2013?通州区二模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.